Vieninė mẽdžiaga, sudėtinė mẽdžiaga, stabiliáusioji vieninė mẽdžiaga, alotròpinė atmainà, standártinė susidãrymo entálpija, Hèso dėsnis, degimo reãkcija.
Vieninės medžiagos
Tik iš vieno elemento atomų sudarytos medžiagos vadinamos vieninėmis, o iš dviejų ar daugiau elementų – sudėtinėmis. Pavyzdžiui, O2, O3, H2 yra vieninės, o H2O, H2O2 – sudėtinės medžiagos. Jeigu elementas sudaro kelias vienines medžiagas (pavyzdžiui, O2 ir O3), sakoma, kad jam būdinga alotropija, o to elemento vieninės medžiagos vadinamos alotròpinėmis atmainomis. O3 vadinamas ozonu, arba trideguoniu. O2 dažniausiai vadiname tiesiog deguonimi, nors informatyvesnis pavadinimas yra dideguonis. O2 veikiant ultravioletine spinduliuote, susidaro O3 molekulės. Spinduliuotei nebeveikiant, O3 molekulės skyla, ir vėl susidaro O2. Tad O2 yra patvaresnė, stabilesnė vieninė medžiaga už O3. Anglies alotropinės atmainos yra grafitas C(grafitas), deimantas C(deimantas), fuleranas C60, grafenas. Iš jų patvariausias grafitas. Daugeliui vieninių medžiagų alotropija nebūdinga, jos skiriasi tik agregatine būsena. Medžiagos agregatinės būsenos kitimas susijęs su energijos pokyčiais. Patvariausia laikoma tokia vieninės medžiagos agregatinė būsena, kokios ji būna 25° C temperatūroje. Pavyzdžiui, vandenilis H2(d), bromas Br2(s), natris Na(k).
Standartinė susidarymo entalpija
1 mol sudėtinės medžiagos susidarymo iš patvariausiųjų vieninių medžiagų šiluminis efektas vadinamas tos sudėtinės medžiagos standártine susidãrymo entálpija ∆fH°2 (čia f reiškia „sudaryti“ (lot. fōrmātio). Pavyzdžiui, dujinio vandens standartinė susidarymo entalpija yra –242 kJ/mol:
∆fH° = –242 kJ/mol.
(5.3.1)
2 Senesnėje literatūroje vartojamas žymėjimas ∆H°f (raidė f parašyta iš dešinės). Abu žymėjimai reiškia tą patį.
Žinoma, 1 mol dujinio vandens galėtų susidaryti vandeniliui reaguojant su ozonu, tačiau šios reakcijos šiluminis efektas nėra lygus standartinei susidarymo entalpijai, nes ozonas nėra patvariausioji deguonies vieninė medžiaga:
∆H° = –290 kJ/mol.
(5.3.2)
Patvariausiųjų vieninių medžiagų standartinę susidarymo entalpiją susitarta laikyti lygią nuliui. Visų kitų medžiagų entalpija lyginama su šiuo sutartiniu nuliu. Medžiagų standartinių susidarymo entalpijų lentelė pateikta vadovėlio 5 priede. Jei kyla abejonių, kurios vieninės medžiagos standartinė susidarymo entalpija pasirinkta už nulį, tai irgi galite pasitikslinti šioje lentelėje.
1 pavyzdys
Sureagavus vandenilio H2 ir deguonies O2 dujoms, susidarė 1,00 g skysto vandens ir išsiskyrė 15,9 kJ šilumos. Matavimai atlikti esant 1 bar slėgiui.
- Sudarykite 1 mol skysto vandens susidarymo termocheminę lygtį.
- Palyginkite sudarytą lygtį su pirmiau pateikta 1 mol dujinio vandens susidarymo termochemine lygtimi (5.3.1) ir paaiškinkite, kodėl skiriasi šių reakcijų energinis efektas.
- Sudarykite vandens kondensavimo termocheminę lygtį.
Sprendimas
- Žinome, kad susidarant 1,00 g skysto vandens išsiskyrė 15,9 kJ energijos. Jei būtų susidaręs 1 mol (18,02 g) vandens, energijos būtų išsiskyrę 18,02 karto daugiau. Sudarome proporciją:
iš čia x = –286,518 kJ ≈ – 286 kJ.
Termocheminė lygtis:
∆fH° = –286 kJ/mol.
(5.3.3)
Komentaras. Atkreipkite dėmesį, kad termocheminėse lygtyse naudojami trupmeniniai koeficientai. Junginio susidarymo entalpija nurodoma vienam moliui medžiagos, todėl prie susidarančios medžiagos koeficientas būtinai turi būti vienetas, o prie kitų medžiagų koeficientai priderinami taip, kad lygtis būtų išlyginta. Jie gali būti ir sveikieji skaičiai, ir trupmeniniai.
- Susidarant 1 mol dujinio vandens, išsiskiria 242 kJ energijos (žr. (5.3.1) lygtį), susidarant 1 mol skysto vandens, išsiskiria 286 kJ energijos, t. y. 44 kJ daugiau. Taip yra todėl, kad kondensacijos procesas yra egzoterminis – kondensuojantis vandens garams (dujiniam vandeniui), išsiskiria energija.
- Kondensuojantis 1 mol vandens, išsiskiria 44 kJ energijos. Tai užrašoma termochemine lygtimi:
H2O(d) → H2O(s); ∆H° = –44 kJ/mol.
(5.3.4)
Komentaras. Termocheminėmis lygtimis galima užrašyti ne tik chemines reakcijas, bet ir fizikinius virsmus, pavyzdžiui, dujinės medžiagos virsmą skysčiu.
Heso dėsnis
Germanas Hesas (German Hess, 1802–1850) energijos tvermės dėsnį pritaikė cheminėms reakcijoms. Mūsų pirmiau nagrinėtas skysto vandens susidarymas gali vykti dviem pakopomis – iš pradžių susidaro dujinis vanduo, vėliau jis kondensuojasi. Arba gali vykti viena pakopa – iš karto susidaro skystas vanduo.
Hèso dėsnis: ar procesas vyksta keliomis pakopomis, ar tiesiogiai, atskirų pakopų entalpijos pokyčių suma yra lygi tiesioginio proceso entalpijos pokyčiui.
Mes šiuo dėsniu jau pasinaudojome skaičiuodami, kiek energijos išsiskiria kondensuojantis 1 mol vandens garų. Kondensuojantis 1 mol dujinio vandens, išsiskiria tiek šilumos, kiek skiriasi dujinio ir skysto vandens standartinė susidarymo entalpija. Tai pavaizduota 5.3.1 paveikslo diagrama.
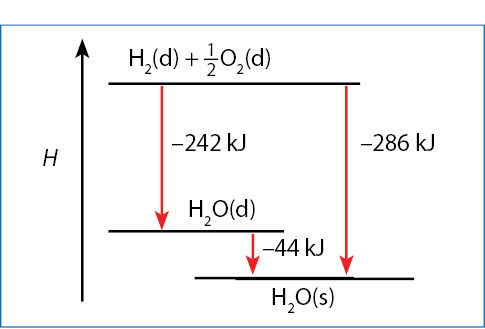
Hipotetinis reakcijos skaidymas pakopomis
Bet kurią cheminę reakciją patogu hipotetiškai suskaidyti į dvi pakopas:
- reaguojančiųjų medžiagų skilimo į vienines medžiagas;
- vieninių medžiagų jungimosi, susidarant reakcijos produktams.
Naudojantis tokiu reakcijų suskaidymu, galima apskaičiuoti bet kurios reakcijos standartinį entalpijos pokytį. Tam pakanka žinoti kiekvienos medžiagos standartinę susidarymo entalpiją (žr. 5 priedą).
2 pavyzdys
Etanolio degimo reakcijos lygtis:
CH3CH2OH(s) + 3O2(d) → 2CO2(d) + 3H2O(s).
(5.3.5)
Apskaičiuokite šios reakcijos standartinį entalpijos pokytį ir sudarykite termocheminę lygtį.
Sprendimas
Hipotetiškai suskaidykime reakciją į dvi pakopas:
- etanolis suskyla į grafitą, vandenilį ir deguonį;
- iš grafito, vandenilio ir deguonies susidaro anglies dioksidas ir vanduo.
Pagal Heso dėsnį, degimo reakcijos standartinis entalpijos pokytis bus lygus šių dviejų pakopų entalpijų sumai (5.3.2 pav.).
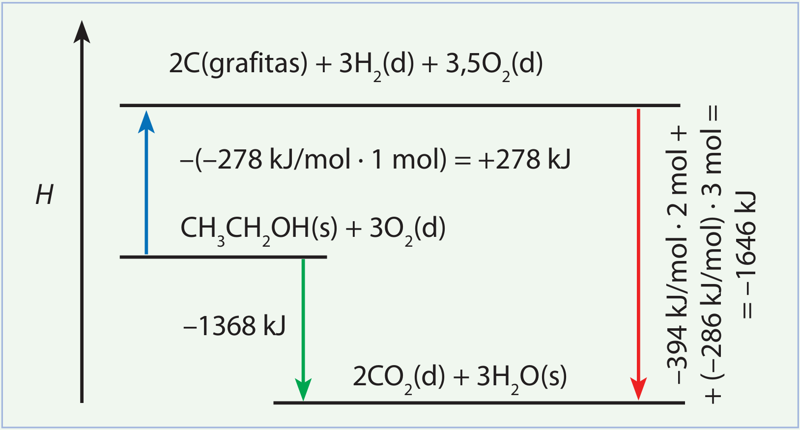
I pakopos šiluminis efektas:
CH3CH2OH(s) + 3O2(d) → 2C(grafitas) + 3H2(d) + 3,5O2(d).
(5.3.6)
5 priede randame, kad standartinės susidarymo entalpijos yra:
∆fH°(CH3CH2OH(s)) = –278 kJ/mol;
∆fH°(O2(d)) = 0 kJ/mol;
∆fH°(C(grafitas)) = 0 kJ/mol;
∆fH°(H2(d)) = 0 kJ/mol.
Pirmoji pakopa yra atvirkščia susidarymo reakcijai (etanolis ne susidaro, o yra skaidomas į vienines medžiagas). Todėl šios pakopos šiluminis efektas yra priešingo ženklo nei etanolio susidarymo entalpija. 1 mol etanolio skaidymo į vienines medžiagas standartinis entalpijos pokytis lygus +278 kJ.
II pakopos šiluminis efektas:
2C(grafitas) + 3H2(d) + 3,5O2(d) → 2CO2(d) + 3H2O(s).
(5.3.7)
5 priede randame, kad:
∆fH°(CO2(d)) = –394 kJ/mol;
∆fH°(H2O(s)) = –286 kJ/mol.
Anglies dioksido susidaro 2 mol, o vandens 3 mol, tad šios pakopos šiluminis efektas:
–394 kJ/mol · 2 mol + (–286 kJ/mol) · 3 mol = –1646 kJ.
I ir II pakopos šiluminių efektų suma:
+278 kJ + (–1646 kJ) = –1368 kJ.
Etanolio degimo termocheminė lygtis:
CH3CH2OH(s) + 3O2(d) → 2CO2(d) + 3H2O(s); ∆H° = –1368 kJ.
(5.3.8)
Komentaras. Termocheminė lygtis rodo, jog etanolio degimo reakcija yra egzoterminė – sudeginus 1 mol skysto etanolio, susidaro 2 moliai dujinio anglies dioksido, 3 mol skysto vandens ir išsiskiria 1368 kJ šilumos.
Reakcijos entalpijos apskaičiavimo formulė
Kad kiekvieną kartą nereikėtų nagrinėti reakcijos skaidymo hipotetinėmis pakopomis, galime apibendrinti 1 pavyzdžio sprendimą taip:

Matematine formule tai užrašoma taip:
∆H°(reakcijos) = Σn · ∆fH°(produktų) – Σn · ∆fH°(reaguojančiųjų medžiagų).
(5.3.9)
Ženklas Σ reiškia sumą. Daugiklis n – medžiagos kiekis moliais sutampa su cheminės lygties koeficientu.
3 pavyzdys
Žaliava azoto rūgščiai gaminti yra amoniakas. Oksiduojant amoniaką, susidaro azoto(II) oksidas. Šį dar kartą oksiduojant, gaunamas azoto(IV) oksidas. Galiausiai, NO2 veikiant vandeniu ir deguonimi, susidaro azoto rūgštis. Apskaičiuokite amoniako oksidacijos reakcijos standartinį entalpijos pokytį:
4NH3(d) + 5O2(d) → 4NO(d) + 6H2O(d); ∆H° = ?
(5.3.10)
Sprendimas
Pirma raskime kiekvienos medžiagos standartinę susidarymo entalpiją ir padauginkime ją iš reakcijoje dalyvaujančios medžiagos kiekio. Lentelėse ieškodami reikiamų duomenų, nepamirškite atsižvelgti į agregatinę būseną (pavyzdžiui, susidaro dujinis ar skystas vanduo).
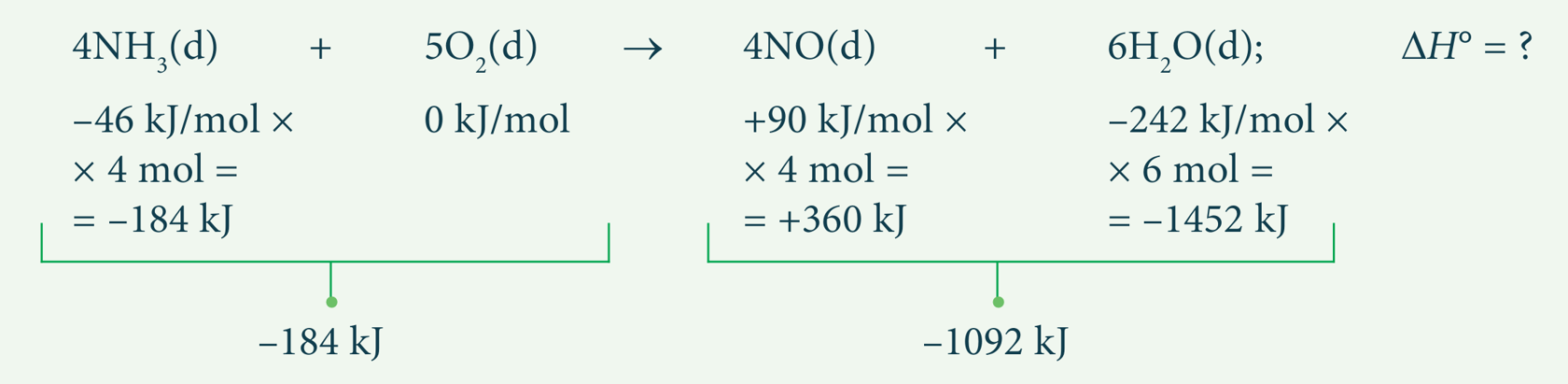
∆H° = produktų susidarymo entalpijų suma – reaguojančiųjų medžiagų susidarymo entalpijų suma = –1092 kJ – (–184 kJ) = –908 kJ.
Atsakymas: –908 kJ.
Klausimai ir užduotys
Atlikdami užduotis reikiamų duomenų ieškokite 5 priede.
- Kurios reakcijos entalpijos pokytis yra lygus HBr(d) standartinei susidarymo entalpijai?
- H+(d) + Br–(d) → HBr(d)
- H(d) + Br(d) → HBr(d)
- H2 (d) + Br2 (d) → 2HBr(d)
\frac{1}{2}\mathrm{H_2\left(d\right)+\frac{1}{2}Br_2\left(d\right)\to} HBr(d)
- Vandenilio chlorido dujų tirpumas vandenyje labai didelis. Vandeninis HCl tirpalas vadinamas druskos rūgštimi. Apskaičiuokite, koks yra 1 mol HCl(d) tirpimo vandenyje šiluminis efektas, t. y. šio proceso standartinį entalpijos pokytį:
HCl(d) → HCl(aq); ∆H° = ?
- Šulinių ir gręžinių vanduo būna kietas. Jis toks tampa, kai ištirpusio anglies dioksido turintis vanduo skverbiasi pro karbonatinius žemės klodus ir juos po truputį tirpina:
CaCO3(k) + CO2(aq) + H2O(s) → Ca2+(aq) + ; ∆H° = ?
Apskaičiuokite šios reakcijos standartinį entalpijos pokytį.
- Gipso įtvarai medicinoje ir vidaus apdailos mišiniai statybose pagaminti iš pusvandenio kalcio sulfato
\mathrm{CaSO_4\cdot\frac{1}{2}H_2O.} Sumaišyta su nedideliu kiekiu vandens, ši medžiaga sukietėja ir virsta kalcio sulfato dihidratu CaSO4 · 2H2O.- Apskaičiuokite reakcijos
\mathrm{CaSO_4\cdot\frac{1}{2}H_2O\left(k\right)+} \frac{3}{2}\mathrm{H_2O\left(s\right)\to} \mathrm{CaSO_4\cdot2\mathrm{H_2O}\left(k\right)} standartinį entalpijos pokytį. - Nurodykite, kokia tai reakcija – egzoterminė ar endoterminė ir kaip pasikeičia kietėjančio mišinio temperatūra.
- Apskaičiuokite, kiek energijos išsiskiria arba sunaudojama, kai su vandeniu reaguoja 1,00 kg pusvandenio kalcio sulfato.
- Apskaičiuokite reakcijos
- Ne visus junginius įmanoma susintetinti iš vieninių medžiagų ir tiesiogiai išmatuoti jų susidarymo entalpiją. Pavyzdžiui, metano susidarymo iš vandenilio ir grafito reakcijos entalpijos tiesiogiai išmatuoti nepavyks. Užtat galima išmatuoti degimo reakcijų entalpiją:
I. CH4(d) + 2O2(d) → CO2(d) + 2H2O(s); ∆H° = –890 kJ.
II. C(grafitas) + O2(d) → CO2(d); ∆fH° = –394 kJ.
III. H2(d) +\frac{1}{2} O2(d) → H2O(s); ∆fH° = –286 kJ.- Kodėl antrosios ir trečiosios reakcijos entalpijos pokytis nurodytas su indeksu f, o pirmosios – be šio indekso?
- Kam lygi grafito ir dujinio dideguonies standartinė susidarymo entalpija?
- Naudodamiesi tik čia pateikta informacija, apskaičiuokite metano standartinę susidarymo entalpiją.
