Fotosintezė
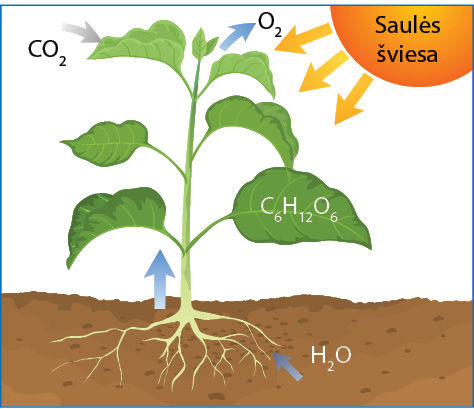
Fotosiñtezė – sudėtingas daugiapakopis procesas, kuriam vykstant sunaudojamas anglies dioksidas ir vanduo. Galutiniai šio proceso produktai yra gliukozė ir deguonis (5.4.1 pav.). Nesigilindami į proceso detales, užrašysime termocheminę šio virsmo lygtį:
6CO2(d) + 6H2O(s) → C6H12O6(aq) + 6O2(d);
∆H° = ?
(5.4.1)
1 pavyzdys
Apskaičiuokite fotosintezės reakcijos standartinį entalpijos pokytį ir paaiškinkite, kodėl fotosintezei vykti reikalinga Saulės šviesa.
Sprendimas
Pirmiausia 5 priede randame kiekvienos medžiagos standartinę susidarymo entalpiją. Reakcijos entalpija apskaičiuojama iš produktų suminės susidarymo entalpijos atėmus reaguojančiųjų medžiagų suminę susidarymo entalpiją:
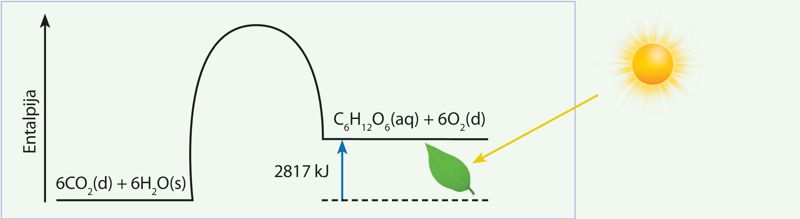
∆H° = [–1263 + 6 · 0] – [6 · (–394) + 6 · (–286)] = +2817 kJ.
Atsakymas: 1 mol gliukozės C6H12O6(aq) susintetinti reikia 2817 kJ energijos (5.4.2 pav.). Šios energijos fotosintetinantys organizmai gauna sugerdami Saulės arba dirbtinę šviesą. Negaunant energijos fotosintezė vykti negali.
Komentaras. Atkreipkite dėmesį, kad šiuo atveju gaunama ne šilumos, o šviesos energija. Reakcijos standartinės entalpijos pokytis ∆H° gali pasireikšti ne tik kaip šiluma. Energija gali būti gaunama arba išskiriama šviesos, elektros energijos ir kitomis formomis.
Ląstelinis kvėpavimas
Kad telefonas veiktų, jį periodiškai reikia prijungti prie kroviklio. Įkraunamoje baterijoje sukaupiama telefonui veikti reikalinga energija (kaip tai įvyksta, nagrinėsime vėliau). Fotosintezė yra Saulės skleidžiamos energijos kaupimo būdas. Tai tarsi baterijos įkrovimas. Išgauti sukauptą energiją galima gliukozę oksiduojant. Taip vyksta ląstelinis kvėpavimas. Nesigilinant į detales, vyksta fotosintezei atvirkščia reakcija:
C6H12O6(aq) + 6O2(d) → 6CO2(d) + 6H2O(s); ∆H° = –2817 kJ.
(5.4.2)
Pagal energijos tvermės dėsnį, kiek energijos sunaudojama vykstant fotosintezei, tiek pat jos išskiriama kvėpuojant.
Maisto produktų energinė vertė
Fotosintezės procesu prasideda visa grandinė cheminių virsmų, kurių rezultatas yra riebalai, baltymai, sudėtiniai angliavandeniai ir kitos medžiagos. Dalis šių medžiagų sunaudojama organizmų energinėms reikmėms patenkinti. Tarptautinės vienetų sistemos (SI) energijos matas yra džaulis (J). Maisto enèrginė vertė dažnai pateikiama kalorijomis (cal). 1 cal apytiksliai atitinka 4,184 J. Painiavos gali kilti dėl to, kad su mityba susijusiuose tekstuose kalorijomis vadinama tai, kas iš tiesų yra kilokalorijos. Tiesa, tokia „maisto kalorija“ paprastai žymima Cal, o ne cal. Tad:
4184 J = 1000 cal = 1 kcal = 1 Cal.
Priklausomai nuo lyties, amžiaus, ūgio, veiklos pobūdžio, žmogui per parą reikia apie 2000–3000 kcal, arba 8400–12500 kJ. Kadangi žmonių organizme fotosintezė vykti negali, reikiamos energijos gauname oksiduodami maistą. Maisto produktų etiketėse pateikiama jų energinė vertė (dažniausiai nurodoma 100 g produkto energinė vertė). Jei maisto vartojama per daug, organizme prasideda riebalų sintezė. Taip organizmas pasirūpina energijos ištekliais ateičiai, jei šios stigtų. Žiemos miego užmiegantys gyvūnai sukaupia riebalų sluoksnį, kuris ir saugo nuo šalčio, ir užtikrina išgyvenimą, kai nėra galimybės maitintis. Žmonių gyvenimo būdas labai pakitęs. Mums nereikia kaupti riebalų, kad išgyventume žiemą. Dėl per didelio riebalų kiekio organizme gali kilti sveikatos sutrikimų. Todėl turime stebėti savo kūno masę, kontroliuoti mitybą ir judėti.
2 pavyzdys
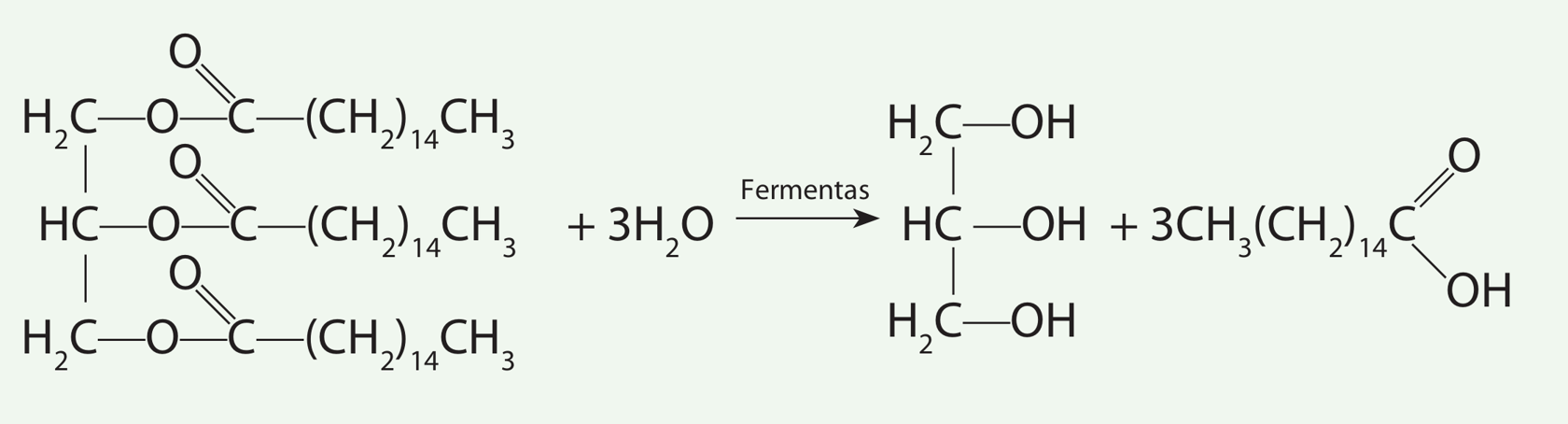
Ant sviesto pakelio nurodyta, kad 100 g produkto energinė vertė yra 3060 kJ, arba 730 kcal. Pagal cheminę sandarą, sviestas yra sočiųjų ir nesočiųjų karboksirūgščių (nuo butano iki oktadekano bei oktadeceno) ir glicerolio esterių mišinys. Tarkime, kad sviestas yra tik heksadekano rūgšties (rūgšties molinė masė 256,48 g/mol) ir glicerolio esteris (riebalų molinė masė 807,49 g/mol). Riebalų metabolizmas organizme prasideda jų suskaidymu į glicerolį ir riebalų rūgštis. Tada riebalų rūgštys oksiduojamos, o išsiskirianti energija panaudojama ATP (adenozintrifosfato) sintezei.
- Parašykite riebalų skaidymo į glicerolį ir riebalų rūgštį reakcijos lygtį. Apskaičiuokite, kiek:
- molių heksadekano rūgšties susidaro iš 0,100 kg riebalų;
- energijos išsiskiria oksidavus b) dalyje apskaičiuotą heksadekano rūgšties kiekį;
- procentų sviesto masės sudaro riebalai.
Sprendimas
-
-
n(heksano rūgšties) = 3 · 0,1238 mol = 0,3715 mol ≈ 0,372 mol.
-
Parašome reakcijos lygtį ir 5 priede randame kiekvienos medžiagos standartinę susidarymo entalpiją (lygtyje parašyta po atitinkamos medžiagos formule).
(5.4.3)
∆H° = 16 · (–286) + 16 · (–394) – (–892) = –9988 kJ/mol;
Q = n · ∆H° = 0,3722 mol · (–9988 kJ/mol) = –3717,5 kJ ≈ –3,72 · 103 kJ.
-
Ant sviesto pakelio nurodyta energinė vertė 3060 kJ/100 g.
Tokiam energijos kiekiui reikia:
x = 82,3 g.
Vadinasi, 100 g sviesto yra 82,3 g riebalų, t. y. 82,3 %.
Nepamirškite, kad mūsų skaičiavimas paremtas prielaida, kad sviestas yra heksadekano rūgšties esteris. Realiame svieste yra įvairių riebalų rūgščių.
Klausimai ir užduotys
- Išnagrinėkite namuose turimų maisto produktų etiketes, raskite nurodytą energinę vertę ir sudarykite sąrašą. Jame įrašykite produkto pavadinimą, energinę vertę kilodžauliais ir kilokalorijomis (jei nurodyta abiem matais). Patikrinkite, ar teisingai kilokalorijos perskaičiuotos į kilodžaulius. Kurie jūsų nagrinėti produktai yra didžiausios energinės vertės, kurie – mažiausios?
- Apskaičiuokite sacharozės, kitaip cukraus C12H22O11, 100 g energinę vertę. Cukraus metabolizavimo produktai yra CO2(d) ir H2O(s). Reikiamų duomenų ieškokite 5 priede.
- Miltiniai patiekalai, ryžiai, bulvės yra krakmolo šaltinis. Krakmolo standartinė susidarymo entalpija –1356 kJ/mol. Krakmolas yra polimerizuota gliukozė, jo formulę galime užrašyti (C6H10O5)n, tad nurodyta vieno molio besikartojančių krakmolo grandžių entalpija. Apskaičiuokite 100 g krakmolo energinę vertę.
- Baltymų gauname vartodami mėsą, žuvį, kiaušinius, pieno produktus, riešutus, sėklas, pupeles, žirnius. Dalį su maistu gautų baltymų organizmas sunaudoja energijai išgauti, t. y. oksiduoja. Baltymai yra aminorūgščių polimerai. Apskaičiuokite, kiek energijos galėtų išsiskirti metabolizavus 0,100 kg alanino NH2CH(CH3)COOH. Laikykite, kad oksiduojant alaniną susidaro dujinis anglies(IV) oksidas, dujinis azotas ir skystas vanduo. Gautą rezultatą laikysime apytiksle baltymų energine verte.
- Palyginkite 2 pavyzdyje apskaičiuotą riebalų ir 2, 3 bei 4 užduotyse apskaičiuotas sacharozės, krakmolo ir baltymų energines vertes (išreikštas 100 g grynos medžiagos) ir išrikiuokite nuo daugiausiai iki mažiausiai energijos teikiančios medžiagos.
