Santrauka
Energija nei sukuriama, nei sunaikinama. Ji tik perduodama iš vienos sistemos kitai.
Vykstant cheminėms reakcijoms, vieni ryšiai nutraukiami, kiti susidaro.
Jeigu pradiniams ryšiams nutraukti energijos sunaudojama mažiau, nei jos išsiskiria susidarant naujiems (tvirtesniems) ryšiams, reakcijos mišinys įkaista. Todėl energija šilumos pavidalu išskiriama į aplinką. Vyksta egzoterminė reakcija.
Jeigu pradiniams ryšiams nutraukti energijos sunaudojama daugiau, nei jos išsiskiria susidarant naujiems ryšiams, reakcijos mišinys atšąla. Todėl šiluminė energija sugeriama iš aplinkos. Vyksta endoterminė reakcija.
Proceso šiluminis efektas priklauso tik nuo medžiagų galutinės ir pradinės būsenos skirtumo ir nepriklauso nuo to, per kelis etapus pradinės medžiagos paverčiamos galutinėmis.
Reakcijos šiluminį efektą patogu apskaičiuoti naudojantis medžiagų standartinių susidarymo entalpijų lentelėmis.
Praktinės užduotys
1. Etanolio degimo entalpijos matavimas
Reikės
Laboratorinio stovo su tvirtinimo laikikliais (1 pav.), kūginės kolbos, termometro, vandens, spiritinės lemputės su etanoliu.
Pirmiausia perskaitykite tyrimo žingsnių nurodymus ir nusibraižykite lentelę tyrimo rezultatams užsirašyti.
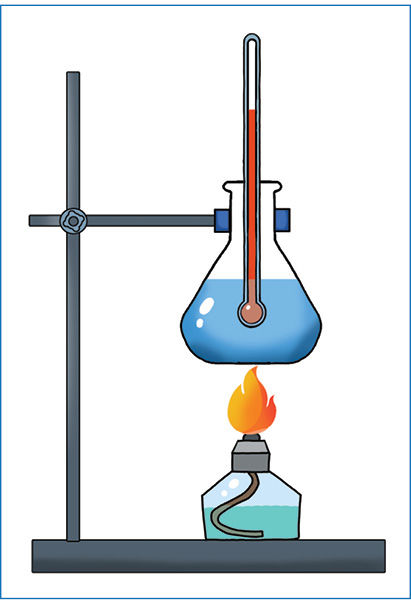
Tyrimo žingsniai
- Pasverkite tuščią kūginę kolbą (duomenis užsirašykite lentelėje) ir į ją įpilkite apie 100–150 g vandens (užsirašykite, kiek iš tikrųjų įpylėte). Vandenį naudokite kurį laiką pastovėjusį klasėje, kad jo temperatūra būtų lygi aplinkos temperatūrai. Įtvirtinkite kolbą su vandeniu ir termometrą laboratoriniame stove. Užsirašykite vandens temperatūrą.
- Pasverkite spiritinę lemputę kartu su joje esančiu etanoliu ir lemputės gaubtu. Užsirašykite masę.
- Uždekite spiritinę lemputę ir stebėkite vandens temperatūros kitimą. Kai vandens temperatūra padidės 25–30 °C, užgesinkite spiritinę lemputę (gesinkite uždėdami jos gaubtą ant dagties). Užsirašykite vandens temperatūrą.
- Pasverkite spiritinę lemputę (kartu su gaubtu). Užsirašykite masę.
Duomenų analizė
- Iš spiritinės lemputės masės pokyčio apskaičiuokite sudegusio etanolio kiekį moliais.
- Laikykime, kad visa degant išsiskyrusi energija sunaudota vandeniui šildyti. Šilumos kiekis, kurį sugėrė vanduo, apskaičiuojamas taip:
Q\left(\mathrm{H_2O}\right)=m\left(\mathrm{H_2O}\right)\cdot4,2\frac{\mathrm{J}}{\mathrm{g\cdot\degree C}}\cdot\Delta T;
čia Q(H2O) – vandens sugertas energijos kiekis (J); m(H2O) – šildomo vandens masė gramais, ∆T – temperatūros pokytis (°C). Skaičius 4,2 vadinamas vandens savitąja šiluma, jis rodo, kad 4,2 J energijos vieno gramo vandens temperatūrą padidina vienu laipsniu. - Vanduo sugėrė tiek energijos, kiek jos išsiskyrė degant etanoliui. Kas vienam yra „energinis praturtėjimas“, kitam yra „energinis nuskurdimas“. Todėl Q(H2O) ir Q(reakcijos) yra priešingo ženklo dydžiai:
Q(H2O) = –Q(reakcijos).
Apskaičiuokite etanolio degimo entalpiją. Ji skaičiuojama vienam moliui degančios medžiagos, tad etanolio degimo reakcijos entalpija yra lygi:
ΔH°(etanolio degimo reakcijos) =
- Parašykite etanolio degimo reakcijos lygtį ir apskaičiuokite jos entalpijos pokytį, naudodamiesi 5 priedo duomenimis. Apskaičiuokite eksperimentu nustatytos entalpijos pokyčio absoliučiąją ir santykinę paklaidą.
- Nenusiminkite, jei jūsų paklaida gana didelė. Paklaida atsirado ne dėl jūsų kaltės, o dėl paties bandymo netobulumo. Apsvarstykite padarytas prielaidas ir nurodykite bent dvi priežastis, kurios neišvengiamai turi įtakos matavimo tikslumui.
2. Neutralizacijos reakcijos standartinio entalpijos pokyčio matavimas
Reikės
1,0 mol/dm3 natrio hidroksido NaOH(aq) tirpalo, 1,0 mol/dm3 H2SO4(aq) tirpalo, 0,1 % fenolftaleino indikatoriaus tirpalo, laboratorinio stovo su laikikliais, biuretės (25 cm3), pipetės (20 cm3), termometro, milimetrinio popieriaus.
Tirpalai turėtų kurį laiką pastovėti klasėje, kad nusistovėtų temperatūra.
Atlikdami bandymą matuosite reaguojančiojo mišinio temperatūrą, todėl svarbu sumažinti energijos nuostolius. Bandymui galima naudoti 100 cm3 stiklinę, įstatytą į didesnę stiklinę, išklotą vata.
Persibraižykite lentelę ir joje įrašykite bandymo duomenis.
Įpilto sieros rūgšties tirpalo tūris, cm3 | Tirpalo spalva | Tirpalo temperatūra |
0 | | |
1 | | |
2 | | |
ir t.t. | | |
Tyrimo žingsniai
- Biuretę pripildykite 1,0 mol/dm3 sieros rūgšties tirpalo.
- Į 100 cm3 stiklinę įpilkite 20 cm3 1,0 mol/dm3 NaOH tirpalo, įlašinkite fenolftaleino tirpalo, įdėkite termometrą ir išmatuokite temperatūrą. Užpildykite lentelės pirmąją eilutę.
- Iš biuretės į stiklinę su natrio hidroksido tirpalu įpilkite 1,0 cm3 sieros rūgšties tirpalo. Pamaišykite tirpalą stiklinėje. Po 15–20 sekundžių pažiūrėkite termometro rodmenis ir užsirašykite duomenis.
- Dar kartą įpilkite 1,0 cm3 sieros rūgšties tirpalo ir po 15–20 sekundžių užsirašykite temperatūrą. Taip kartokite, kol supilsite 20 cm3 sieros rūgšties.
Duomenų analizė
- Sudarykite linijinį grafiką. X ašyje pažymėkite sieros rūgšties tirpalo tūrį, o γ ašyje –reaguojančiojo mišinio temperatūrą. Grafike kryžiuku pažymėkite, kiek sieros rūgšties tirpalo įpylus pasikeitė tirpalo spalva.
- Kaip kinta temperatūra tyrimo pradžioje? Kodėl ji taip kinta?
- Kaip kinta temperatūra pasikeitus indikatoriaus spalvai? Kodėl ji taip kinta?
- Per temperatūros matavimo taškus iki indikatoriaus spalvos pokyčio taško nubrėžkite tiesę (tikėtina, kad taškai yra šiek tiek išsibarstę, tad tiesę brėžkite taip, kad ji būtų simetriška taškams). Kitą tiesę brėžkite po indikatoriaus spalvos pokyčio. Užsirašykite šių dviejų tiesių sankirtos taško koordinates (koks sieros rūgšties tirpalo tūris ir kokia temperatūra).
- Apskaičiuokite maksimalų temperatūros pokytį ∆T (iš tiesių sankirtos tašką atitinkančios temperatūros atimkite pradinę tirpalo temperatūrą).
- Apskaičiuokite tirpalo tūrį, kuriam esant buvo maksimali temperatūra (prie 20 cm3 pradinio NaOH tirpalo tūrio pridėkite dviejų tiesių sankirtos tašką atitinkančio sieros rūgšties tirpalo tūrį). Tirpalo tankis yra labai artimas 1,0 g/cm3, tad tirpalo masė m(tirpalo) skaitine reikšme sutampa su tirpalo tūriu.
- Energija, kuri išsiskiria natrio hidroksidui reaguojant su sieros rūgštimi Q(reakcijos), sunaudojama tirpalui šildyti Q(tirpalo).
Q(tirpalo) = –Q(reakcijos);
Q(tirpalo) = m(tirpalo) ·4,2\frac{\mathrm{J}}{\mathrm{g\cdot\degree C}}\cdot\Delta T. - Apskaičiuokite sureagavusios sieros rūgšties kiekį moliais n(sieros rūgšties).
- Apskaičiuokite tiriamosios reakcijos standartinį entalpijos pokytį:
∆H°(neutralizacijos reakcijos) =\frac{Q\left(\mathrm{reakcijos}\right)}{n\left(\mathrm{sieros\ rūgšties}\right)}. - Apskaičiuokite šios reakcijos standartinį entalpijos pokytį, naudodamiesi 5 priedo duomenimis.
- Palyginkite savo eksperimentu nustatytą entalpiją su apskaičiuotąja. Kokia yra jūsų matavimų absoliučioji ir santykinė paklaida? Apsvarstykite, kas galėjo lemti susidariusią paklaidą.
Papildomos užduotys
Atliekant užduotis daug kur reikės medžiagos standartinės susidarymo entalpijos. Šiuos duomenis rasite 5 priede.
- Mėgintuvėlyje vyksta cheminė reakcija. Temperatūra mėgintuvėlio viduje 15 °C. Išorėje temperatūra 20 °C. Kokia yra šilumos perdavimo kryptis – iš aplinkos į mėgintuvėlį ar atvirkščia? Atsakymą paaiškinkite.
- Kurios medžiagos standartinė susidarymo entalpija nėra lygi nuliui?
- O3(d)
- Cl2(d)
- C(grafitas)
- Br2(s)
- Kurios medžiagos standartinė susidarymo entalpija nėra lygi nuliui?
- Ar(d)
- Na(d)
- O2(d)
- N2(d)
- Šarminiai ir šarminių žemių metalai reaguoja su vandeniu. Reakcija vyksta tuo didesniu greičiu ir tuo audringiau, kuo ryškesnės metališkosios savybės (prisiminkite elementų periodiškumo dėsningumus).
- Kuris iš vienoje poroje nurodytų metalų su vandeniu reaguoja audringiau: natris ar kalis; kalis ar kalcis?
- Vienam moliui kalio sureagavus su vandeniu, išsiskiria 196 kJ energijos. Parašykite termocheminę kalio reakcijos su vandeniu lygtį.
- Sumušimo, patempimo atvejais pažeistą vietą rekomenduojama šaldyti. Tam tinka šaldomieji paketai. Tokio paketo viduje yra druska (pavyzdžiui, amonio nitratas) ir kapsulė su vandeniu. Susižeidus reikia užčiuopti paketo viduje esančią kapsulę ir ją sulaužyti. Vanduo išsilieja, tirpina pakete esančias druskas ir atšąla.
- Koks procesas vyksta šaldomajame pakete – endoterminis ar egzoterminis?
- Parašykite jonų, iš kurių sudarytas amonio nitratas, formules.
- Amonio nitrato tirpimą galima suskirstyti į du etapus.
- Tirpstant amonio nitrato kristalui, nutraukiami ryšiai tarp jonų. Šiame etape energija .................... (sunaudojama / išskiriama).
- Iš kristalo atsiskyrę jonai sudaro ryšius su vandens molekulėmis. Šiame etape energija ..................... (sunaudojama / išskiriama).
- Tirpalas atšąla, nes:
- I etape energijos sunaudojama daugiau, nei jos išsiskiria II etape;
- I etape energijos sunaudojama mažiau, nei jos išsiskiria II etape;
- I etape energijos išsiskiria daugiau, nei jos sunaudojama II etape;
- I etape energijos išsiskiria mažiau, nei jos sunaudojama II etape.
- Išsiliejus vandeniui, amonio nitratas ištirpsta:
NH4NO3(k) → NH4NO3(aq).
(1)
Apskaičiuokite šio proceso standartinį entalpijos pokytį.

- Apskaičiuokite reakcijos standartinį entalpijos pokytį:
- C(grafitas) + O2(d) → CO2(d);
- C(deimantas) + O2(d) → CO2(d);
- H2(d) + Br2(s) → 2HBr(d);
- H2(d) + Br2(d) → 2HBr(d);
- H2(d) + Br2(d) → 2HBr(aq).
- Aliuminis reaguoja su geležies(III) oksidu:
Fe2O3(k) + 2Al(k) → 2Fe(k) + Al2O3(k).
(2)
- Apskaičiuokite šios reakcijos standartinį entalpijos pokytį. Nurodykite, kaip kinta reakcijos mišinio temperatūra vykstant reakcijai.
- Ši reakcija prasideda tik pakaitinus mišinį. Paaiškinkite, kodėl mišinį pradžioje reikia pakaitinti.
- Bario jonams jungiantis su sulfato jonais, susidaro baltų, azoto rūgšties tirpale netirpstančių nuosėdų. Ši reakcija padeda atpažinti bario arba sulfato jonus. Cheminėje stiklinėje sumaišyti bario chlorido ir kalio sulfato tirpalai.
- Parašykite reakcijos bendrąją lygtį. Nurodykite medžiagų agregatines būsenas.
- Sudarykite reakcijos sutrumpintąją joninę lygtį. Nurodykite, kurie jonai nedalyvauja reakcijoje.
- Apskaičiuokite b) dalyje parašytos reakcijos standartinį entalpijos pokytį. Paaiškinkite, kodėl skaičiuojant standartinį entalpijos pokytį nebūtina žinoti kalio ir chlorido jonų standartinę susidarymo entalpiją.
- Metalus suvirinant dujomis naudojamas degiklis, į kurį tiekiamos etino ir gryno deguonies dujos. Etinui degant pasiekiama labai aukšta temperatūra, kurios pakanka metalinėms detalėms sujungti lydant. Etinas gaunamas techninį (su priemaišomis) kalcio karbidą CaC2 veikiant vandeniu. Naudotas kalcio karbidas, kuriame priemaišos sudaro 20,0 % masės. Kiek energijos gaunama sudeginus visą etiną, kuris gautas vandeniu veikiant 0,24 kg techninio kalcio karbido?
- Ten, kur kas nors dega didelio slėgio ir aukštos temperatūros sąlygomis (pavyzdžiui, automobilių varikliuose), susidaro azoto monoksido ir azoto dioksido teršalų. Rengdama ataskaitas apie oro taršą, Lietuvõs aplinkos ministerija nurodo bendrą į atmosferą patekusių azoto oksidų kiekį, netikslindama, kiek kurio. Taip yra todėl, kad azoto monoksidas reaguoja su dideguonimi ir virsta azoto dioksidu:
2NO(d) + O2(d) → 2NO2(d).
(3)
Kai aplinkoje yra dideguonies ir vandens, vyksta reakcija:
4NO2(d) + 2H2O(d) + O2(d) → 4HNO3(aq).
(4)
- Apskaičiuokite (3) ir (4) reakcijos standartinį entalpijos pokytį. Kokios tai reakcijos pagal entalpijos pokyčio ženklą?
- Paaiškinkite, kokią žalą daro į aplinką patenkantys azoto oksidai.
- Gaminant azoto rūgštį (4) reakcija vykdoma pramoniniu mastu. Gryna azoto rūgštis nelabai patvari, todėl šią rūgštį gaminančios įmonės parduoda 60 % vandeninį tirpalą, kuris vadinamas koncentruota azoto rūgštimi. Kiek kilogramų azoto dioksido sunaudojama gaminant 1,00 t tirpalo, kuriame azoto rūgšties masės dalis 60,0 %?
- Šiaurės Lietuvojè, daugiausia Akmenės rajone, yra didelių klinties klodų. Klintis – tai nuosėdinė uoliena, apie 80 % jos masės sudaro kalcio karbonatas. Klintis naudojama gaminant cementą, statybines kalkes. Kaitinant klintį aukštoje temperatūroje, vyksta skilimo reakcija:
CaCO3(k) → CaO(k) + CO2(d); ∆H° = 176 kJ.
(5)
Energija šiai reakcijai vykti gaunama deginant gamtines dujas, kurių pagrindinė sudedamoji dalis yra metanas:
CH4(d) + 2O2(d) → CO2(d) + 2H2O(d); ∆H° = –802 kJ.
(6)
- Kuri iš reakcijų yra endoterminė – (5) ar (6)?
- Atvirame ore bazinis CaO oksidas sugeria anglies(IV) oksidą ir virsta kalcio karbonatu. Parašykite šios reakcijos termocheminę lygtį.
- Kiek energijos sunaudojama iš kalcio karbonato gaminant 1,00 t degtų kalkių (t. y. CaO)? Jeigu visa ši energija gaunama deginant metaną, kiek kilogramų metano sunaudojama gaminant 1,00 t degtų kalkių?
- Statybinių medžiagų – degtų kalkių, cemento – gamyba pastebimai prisideda prie klimato kaitos. Remdamiesi pirmiau pateikta informacija ir savo c) dalies skaičiavimais, nurodykite du veiksnius, kurie daro įtaką klimato kaitai.
- Deguonis ir siera yra 16 grupės elementai. Abu turi šešis valentinius elektronus, abiejų mažiausias oksidacijos laipsnis yra –2, tad su vandeniliu sudaro junginius H2O ir H2S.
- Kurio iš šių dviejų junginių rūgštinės savybės stipresnės?
- Parašykite šių junginių reakcijos su kalcio oksidu bendrąsias lygtis.
- Kai kurios šių junginių savybės labai skiriasi:
| Lydymosi entalpija (rodo, kiek energijos sunaudojama 1 mol kietosios medžiagos virstant skysčiu). | Garavimo entalpija (rodo, kiek energijos sunaudojama 1 mol skystosios medžiagos virstant dujomis). |
H2O | 6,0 kJ/mol | 44 kJ/mol |
H2S | 2,4 kJ/mol | 19 kJ/mol |
Paaiškinkite, kodėl nurodytos vandens entalpijos reikšmės gerokai didesnės negu vandenilio sulfido.
- Apskaičiuokite, kiek energijos sunaudojama išgarinant 1,0 g vandens ir 1,0 g vandenilio sulfido.
- Dviejose stiklinėse yra vienodas 25 °C temperatūros vandens kiekis. Į vieną stiklinę įdėta 1,0 mol kalio hidroksido KOH(k), į kitą 1,0 mol kalio sulfato K2SO4(k). Nurodykite, kaip tirpstant medžiagoms kinta temperatūra vienoje ir kitoje stiklinėje. Atsakymą pagrįskite skaičiavimais.
- 150 g masės obuolio energinė vertė 325 kJ. Tarkime, kad obuolys sudarytas iš vandens, ląstelienos (kurios organizmas nepasisavina) ir fruktozės. Toks supaprastintas obuolys energijos suteikia tik dėl jame esančios fruktozės. Apskaičiuokite, kiek gramų fruktozės yra šiame obuolyje. ∆fH°(fruktozės(aq)) = –1267 kJ/mol.
- Palyginkite dvi reakcijas:
C(grafitas) + 2H2(d) → CH4(d);
(7)
C(d) + 4H(d) → CH4(d).
(8)
- Kurios reakcijos standartinė entalpija sutampa su metano susidarymo standartine entalpija?
- Apskaičiuokite (8) reakcijos standartinį entalpijos pokytį.
- Remdamiesi b) dalies atsakymu, nurodykite C–H ryšio entalpiją.
- Vandenilio chlorido dujos labai gerai tirpsta vandenyje. Susidaręs vandeninis tirpalas HCl(aq) vadinamas druskos rūgštimi. 1,000 kg vandens ištirpinta 0,430 kg vandenilio chlorido. Apskaičiuokite:
- vandenilio chlorido masės dalį (procentais) susidariusiame tirpale;
- vandenilio chlorido molinę koncentraciją tirpale, jei jo tankis 1,15 g/cm3;
- kiek šilumos išsiskyrė ar buvo sugerta tirpinant vandenilio chloridą vandenyje.
Paimta 0,100 dm3 pagaminto tirpalo ir praskiesta vandeniu. Naujojo tirpalo tūris 1,000 l. Apskaičiuokite: - vandenilio chlorido molinę koncentraciją naujajame tirpale;
- tirpalo vandenilio jonų rodiklį pH (jis yra lygus neigiamam vandenilio jonų molinės koncentracijos logaritmui: –lg(c(H+)), o druskos rūgšties tirpale visos HCl molekulės yra suskilusios į jonus).
- išsiskyrusios arba sunaudotos šilumos kiekį, jeigu 30,0 cm3 naujojo tirpalo neutralizuota pripylus natrio hidroksido tirpalo.
