Senų knygų puslapiai pageltę, trupantys. Popierius lėtai reaguoja su aplinkos medžiagomis. Padegtos bengališkos (šaltosios) ugnelės sudega per kelias minutes, t. y. degimo reakcija vyksta sparčiai. Ant vaistų ir maisto medžiagų pakuočių nurodomas produkto galiojimo laikas, nes produktas neišvengiamai kinta. Suprantant cheminių reakcijų greitį lemiančius dėsningumus, reakcijas įmanoma sulėtinti arba paspartinti, apskaičiuoti, kiek laiko išgerti vaistai išliks organizme. Cheminių reakcijų greičio dėsningumus nagrinėjanti sritis vadinama chemine kinetika.

Išnagrinėję šį skyrių, gebėsite:
- apibrėžti, ką vadiname cheminės reakcijos greičiu;
- apskaičiuoti vidutinį cheminės reakcijos greitį;
- paaiškinti, kodėl didinant koncentraciją reakcija spartėja;
- apibūdinti dujų slėgio įtaką cheminių reakcijų greičiui;
- paaiškinti katalizatorių įtaką cheminių reakcijų greičiui;
- numatyti, kiek pakis reakcijos greitis pakeitus temperatūrą;
- išmatuoti reakcijos greitį.
Reakcijos greičio apskaičiavimo formulė
Vykstant cheminei reakcijai, reaguojančiosios medžiagos virsta reakcijos produktais (6.1.1 pav.). Vienų kiekis ir koncentracija mažėja, kitų didėja. Kuo spartesnė reakcija, tuo per vieną sekundę labiau pakinta medžiagos koncentracija. Į 1,00 mol/l koncentracijos etano (acto) rūgšties tirpalą įmeskite gabaliuką magnio. Pamatysite išsiskiriančias vandenilio H2 dujas.
2CH3COOH(aq) + Mg(k) → Mg(CH3COO)2(aq) + H2(d).
(6.1.1)
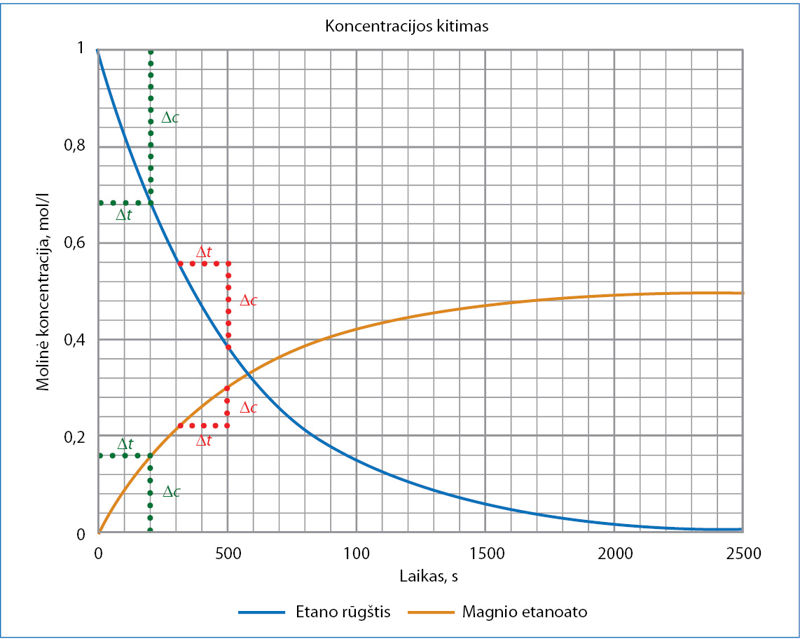
Vykstant reakcijai magnio etanoato koncentracija didėja, o etano rūgšties – mažėja. Magnio etanoato koncentracija (6.1.2 pav.) per pirmąsias 200 sekundžių padidėja:
∆c = c(galutinė) – c(pradinė) = 0,16 mol/l – 0,00 mol/l = 0,16 mol/l.
Reãkcijos greitis rodo, kaip sparčiai kinta medžiagos koncentracija. Jis apskaičiuojamas taip:
Etano rūgšties koncentracija per pirmąsias 200 sekundžių pakinta (žr. 6.1.2 paveiksle pavaizduotas žalias taškines linijas):
∆c = c(galutinė) – c(pradinė) = 0,68 mol/l – 1,00 mol/l = –0,32 mol/l.
Minuso ženklas rodo, kad koncentracija mažėja. Šios medžiagos koncentracijos pokyčio modulis dvigubai didesnis už magnio etanoato, nes 1 mol magnio etanoato pagaminti sunaudojama 2 mol etano rūgšties. Šiuo atveju reakcijos greitį skaičiuojame taip:
čia n – lygties koeficientas prie etano rūgšties formulės. Minuso ženklas prieš formulę rašomas todėl, kad koncentracijos pokytis yra neigiamas. Dalyba iš koeficiento, t. y. iš dvejeto, reikalinga tam, kad matuodami tiek magnio etanoato, tiek etano rūgšties koncentracijos kitimą, gautume tą pačią reakcijos greičio vertę.
Reakcijos greičio apskaičiavimo formulė:
(6.1.2)
Svarbu:
- koncentrãcijos pókytis skaičiuojamas iš galutinės reikšmės atėmus pradinę;
- neigiamas koncentracijos pokytis reiškia, kad koncentracija mažėja;
- greičio apskaičiavimo formulėje minuso arba pliuso ženklas parenkamas taip, kad greitis būtų teigiamas dydis;
- greičio apskaičiavimo formulėje rašoma dalyba iš n (t. y. koeficiento reakcijos lygtyje), kad skaičiuodami pagal bet kurią medžiagą gautume tą pačią skaitinę reakcijos greičio vertę;
- pagal šią formulę apskaičiuojame vidutinį reãkcijos greitį per pasirinktą laiko intervalą.
Reakcija lėtėja
Apskaičiuokime, koks yra vidutinis reakcijos greitis laiko intervalu tarp 300 ir 500 sekundžių (žr. 6.1.2 paveiksle pavaizduotas raudonas taškines linijas). Magnio etanoato koncentracijos pokytis per šį laiką yra 0,090 mol/l, o etano rūgšties – 0,18 mol/l. Vidutinis reakcijos greitis:
Matome, kad šiuo laiko intervalu reakcija vyksta lėčiau. Kuo daugiau laiko praeina nuo reakcijos pradžios, tuo 6.1.2 paveikslo koncentracijos kreivės darosi gulstesnės. Tai rodo, kad koncentracija kinta vis lėčiau. Kodėl reakcijos lėtėja, išsiaiškinsime artimiausioje temoje.
1 pavyzdys
Azoto monoksidui reaguojant su deguonimi, susidaro azoto dioksidas:
2NO(d) + O2(d) → 2NO2(d).
Parašykite vidutinio reakcijos greičio apskaičiavimo formulę, jeigu matuojamas skirtingų medžiagų koncentracijos kitimas.
Sprendimas
NO ir O2 koncentracija mažėja, todėl dviem pirmais atvejais formulėje yra minuso ženklas.
Klausimai ir užduotys
- Vykstant reakcijai
2NO(d) + O2(d) → 2NO2(d),
pradinė NO koncentracija buvo 8,00 · 10–3 mol/dm3. Po 15 min ši koncentracija tapo 7,00 · 10–3 mol/dm3. Apskaičiuokite vidutinį reakcijos greitį per šias 15 min.
- Azoto(IV) oksidas būna dvejopo pavidalo – monomeras azoto dioksidas NO2 arba dimeras diazoto tetroksidas N2O4. Žemesnėje temperatūroje vyraujanti forma yra bespalvis dimeras, o keliant temperatūrą jis skyla ir virsta rudos spalvos NO2:
N2O4(d) → 2NO2(d).
Uždarame nekintančio tūrio inde per pirmąsias 25 sekundes N2O4 koncentracija sumažėjo 0,045 mol/l.
- Kiek per tą patį laiką pakito NO2 koncentracija?
- Pritaikykite 6.1.2 formulę reakcijos greičiui apskaičiuoti tiek pagal vienos, tiek pagal kitos medžiagos koncentracijos pokytį. Paaiškinkite, kuriuo atveju formulėje reikia pliuso, o kuriuo – minuso ženklo? Kuriuo atveju formulėje reikia naudoti dalybą iš 2 ir kodėl?
- Trys eksperimentatoriai tyrė amoniako sintezės reakciją:
N2(d) + 3H2(d) → 2NH3.
Pirmasis stebėjo tik azoto koncentracijos kitimą, antrasis – tik vandenilio, o trečiasis – tik amoniako. Kaip kiekvienas jų turi skaičiuoti reakcijos greitį, kad atlikdami tyrimą su vienodais mišiniais vienodomis sąlygomis visi gautų tokį pat reakcijos greitį? Parašykite, kuris eksperimentatorius kokią reakcijos greičio apskaičiavimo formulę taikys.
- Vandenilio peroksido tirpalas vartojamas tik išoriškai, odos žaizdoms dezinfekuoti. Ši medžiaga nepatvari, palengva skyla, ilgai laikytas tirpalas gali būti neveiksmingas, tad atkreipkite dėmesį į tokio preparato galiojimo laiką. Skilimo reakcija vyksta lėčiau, jei tirpalas laikomas tamsioje, vėsioje vietoje. Skilimo reakcijos lygtis:
2H2O2(aq) → 2H2O(s) + O2(d).
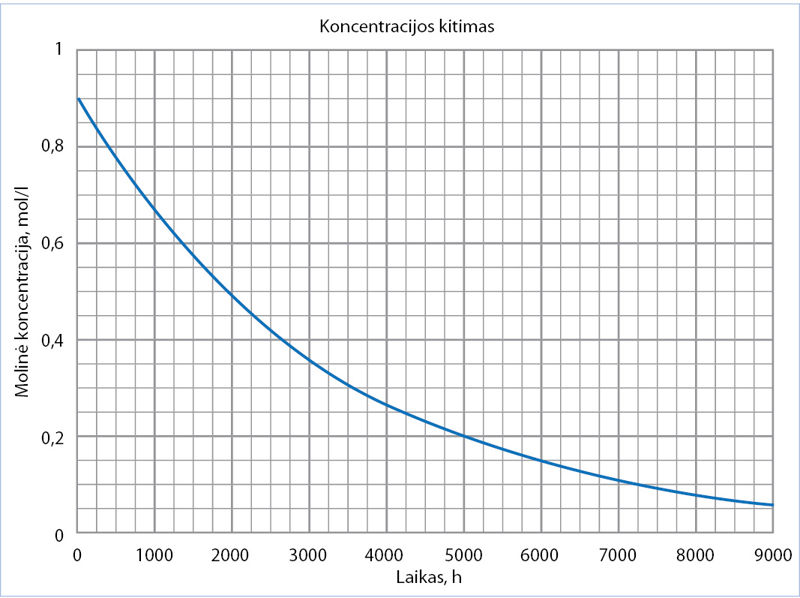
Pradinė vandenilio peroksido koncentracija buvo 0,90 mol/l. 6.1.3 paveiksle parodytas jo koncentracijos kitimas maždaug per vienerius metus. Atkreipkite dėmesį, kad laikas nurodytas valandomis.
- Apskaičiuokite vandenilio peroksido skilimo reakcijos vidutinį greitį per pirmąsias 1000 valandų. Atsakymą išreikškite mol/(l · h).
- Apskaičiuokite vandenilio peroksido skilimo reakcijos vidutinį greitį laiko intervalu tarp 6000 ir 7000 valandų. Atsakymą išreikškite mol/(l · h).
- Apskaičiuokite išsiskyrusio deguonies kiekį moliais per pirmąsias 3000 valandų, jei tirpalo tūris buvo 0,20 litro.