Susidūrimo tikimýbė, koncentrãcija, slėgis, heterogèninė reãkcija, reãkcijos greičio konstánta, kinètinė lygtis, veikiančiųjų mãsių dėsnis.
Reakcijos greitis priklauso nuo:
- reaguojančiųjų medžiagų prigimties;
- dalelių susidūrimo dažnio;
- temperatūros;
- katalizatorių.
Reaguojančiųjų medžiagų prigimtis
Sakant „medžiagų prigimtis“ turimos omenyje medžiagų savybės. Jų pakeisti neįmanoma. Pavyzdžiui, į vandenį patekęs natris reaguoja labai sparčiai, net užsidega, o geležinė vinis drėgnoje vietoje rūdija labai lėtai. Vandeniniuose tirpaluose mainų reakcijos tarp joninių medžiagų vyksta labai greitai. Pavyzdžiui, į natrio chlorido tirpalą įpylus sidabro nitrato tirpalo, nuosėdų atsiranda akimirksniu, o sacharozės (kovalentinės medžiagos) skaidymas į gliukozę ir fruktozę yra gana lėtas procesas.
Dalelių susidūrimo dažnis
Medžiagos reaguoja susidūrus jų dalelėms (molekulėms, jonams, radikalams, atomams). Kuo dažniau susiduria dalelės, tuo sparčiau vyksta reakcija. Susidūrimo dažnis tuo didesnis, kuo:
- didesnė medžiagų koncentracija;
- didesnis slėgis (jei reaguoja dujos);
- didesnis medžiagų sąlyčio plotas (tik vykstant heterogeninei reakcijai, t. y. kai kietoji medžiaga reaguoja su dujomis arba tirpalu).
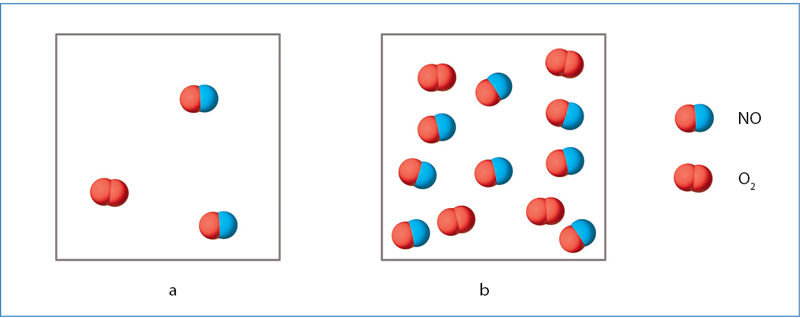
Tiriant reakciją
2NO(d) + O2(d) → 2NO2(d),
nustatyta, kad jos greitis nuo reaguojančiųjų medžiagų koncentracijos priklauso taip:
ν = k · c2(NO) · c(O2).
(6.2.1)
Ši lygtis rodo, kad, didinant NO ir (arba) O2 koncentraciją (žr. 6.2.1 pav.), reakcijos greitis didėja. Atkreipkite dėmesį, kad NO koncentracija pakelti kvadratu. Tad šios medžiagos koncentracijos didinimas daro didesnę įtaką reakcijos greičiui negu O2 koncentracijos didinimas. Jeigu, tarkime, patrigubinsime NO koncentraciją, reakcija paspartės 32 = 9 kartus. Tris kartus padidinus deguonies koncentraciją, reakcija paspartės 3 kartus.
Šiame pavyzdyje laipsnio rodiklis prie NO koncentracijos sutampa su reakcijos lygties koeficientu. Bet tai veikiau atsitiktinumas nei dėsningumas. Paprastai greičio priklausomybės nuo medžiagų koncentracijos lygtyse laipsnio rodikliai neturi nieko bendra su lygties koeficientais. Jie nustatomi tik bandymais, kaitaliojant medžiagų koncentraciją ir matuojant, kaip dėl to pasikeičia reakcijos greitis.
Lygtyje (6.2.1) k raide pažymėta reãkcijos greičio konstánta. Kiekvienos reakcijos greičio konstanta nustatoma bandymais. Skirtingų reakcijų greičio konstantos matavimo vienetai gali būti skirtingi. Nagrinėjamo pavyzdžio atveju iš (6.2.1) lygties galime išreikšti greičio konstantą ir nustatyti jos matavimo vienetus:
(6.2.2)
Kinetinė lygtis
Reakcijos greitis priklauso nuo reaguojančiųjų medžiagų koncentracijų sandaugos. Tarkime, reaguoja trys medžiagos – A, M ir Q:
A + M + Q → Produktai.
Šios reakcijos greičio priklausomybės nuo koncentracijos lygtis yra:
(6.2.3)
Ši priklausomybė vadinama kinètine lygtimi, tačiau tebevartojamas jos ankstesnis pavadinimas veikiančiųjų mãsių dėsnis. Laipsnio rodikliai x, y ir z teoriškai neapskaičiuojami, jie nustatomi atliekant bandymus.
Panagrinėkite lygtis (6.1.2) ir (6.2.3), ką kiekviena jų rodo ir kam naudojama (6.1 lentelė).
6.1 lentelė. Dvi greičio apskaičiavimo lygtys
Lygtis | ||
Ką rodo? | Rodo tai, ką vadiname reakcijos greičiu. Tai reakcijos greičio apibrėžimas. Joje nėra koncentracijos, tik jos pokytis. Reakcijos lygties koeficientas n naudojamas tos medžiagos, kurios koncentracijos pokytis matuojamas. | Rodo, kaip reakcijos greitis priklauso nuo medžiagų koncentracijos. |
Kam skirta? | Vidutiniam reakcijos greičiui apskaičiuoti, jei žinome, per kiek laiko kiek pakinta koncentracija. | Reakcijos greičiui apskaičiuoti tuo momentu, kuriuo žinome visas reaguojančiųjų medžiagų koncentracijas. |
1 pavyzdys
Vandenilio peroksido skilimo reakcijos
2H2O2(aq) → 2H2O(s) + O2(d)
kinetinė lygtis yra:
ν = k · c(H2O2).
- Kokie yra šios reakcijos greičio konstantos matavimo vienetai, jei greitis matuojamas mol/(l · s)?
- Kokia yra greičio konstantos skaitinė vertė? Žinoma, kad kai vandenilio peroksido koncentracija tirpale yra 0,25 mol/l, reakcija vyksta 7,5 · 10–5 mol/(l · s) greičiu.
- Kokiu greičiu vyks vandenilio peroksido skilimas, jei jo koncentracija bus 0,10 mol/l?
Sprendimas
- Iš pateiktos kinetinės lygties išreiškiame konstantą k:
Atsakymas:
- s–1,
- 3,0 · 10–4s–1,
3,0\ \cdot\ 10^{-5}\frac{\mathrm{mol}}{\mathrm{l\ \cdot\ s}}.
2 pavyzdys
Vandenilio ir bromo jungimosi reakcijos
H2(d) + Br2(d) → 2HBr(d)
kinetinė lygtis yra:
Tiriant šią reakciją apskaičiuota, kad vidutinis reakcijos greitis per pirmąsias 15 s yra v1 = 1,5 · 10–3 mol/(l · s). Koks būtų šios reakcijos greitis:
- v2, jeigu pradiniu momentu vandenilio slėgis būtų buvęs dvigubai didesnis?
- v3, jeigu pradiniu momentu bromo slėgis būtų buvęs dvigubai didesnis?
Sprendimas
Dujų slėgis ir koncentracija yra vienas kitam proporcingi dydžiai. Dujų slėgiui padvigubėjus, dujų koncentracija irgi padvigubėja (6.2.2 pav.). Todėl a) atveju kalbama apie dvigubai didesnę pradinę vandenilio koncentraciją, o b) atveju – apie dvigubai didesnę pradinę bromo koncentraciją.
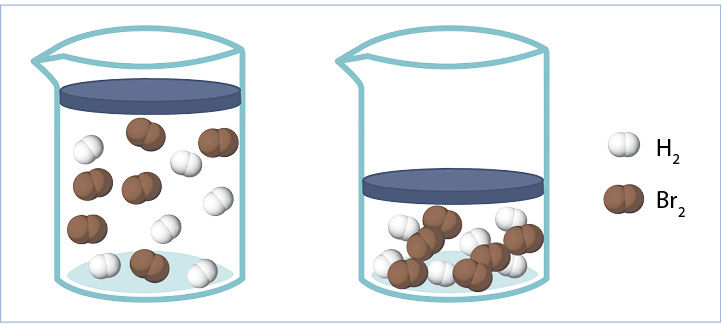
- Apskaičiuosime, kiek kartų greitis v2 skiriasi nuo v1.
Skaitiklis ir vardiklis skiriasi tik tuo, kad vardiklyje vandenilio koncentracija yra c, o skaitiklyje 2c. Suprastinę vienodus dydžius, gauname, kad greičiai skirtųsi du kartus.
- Apskaičiuosime, kiek kartų greitis v2 skiriasi nuo v1.
Skaitiklis ir vardiklis skiriasi tik tuo, kad vardiklyje bromo koncentracija yra c, o skaitiklyje 2c. Suprastinę vienodus dydžius gauname, kad greičiai skirtųsi
Atsakymas:
- 3,0 · 10-3 mol/(l · s);
- 2,1 · 10-3 mol/(l · s).
Heterogeninė reakcija ir paviršiaus ploto įtaka jos greičiui
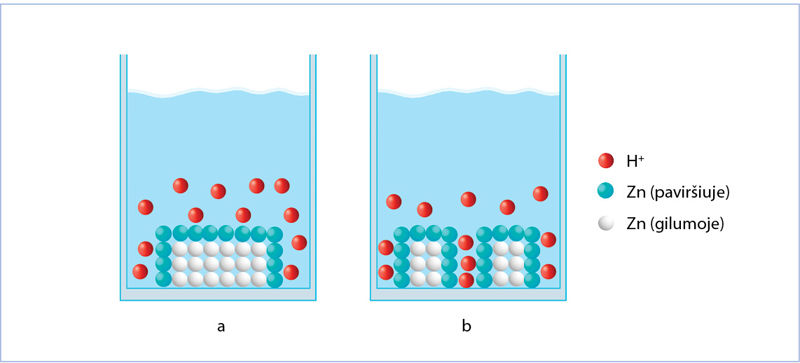
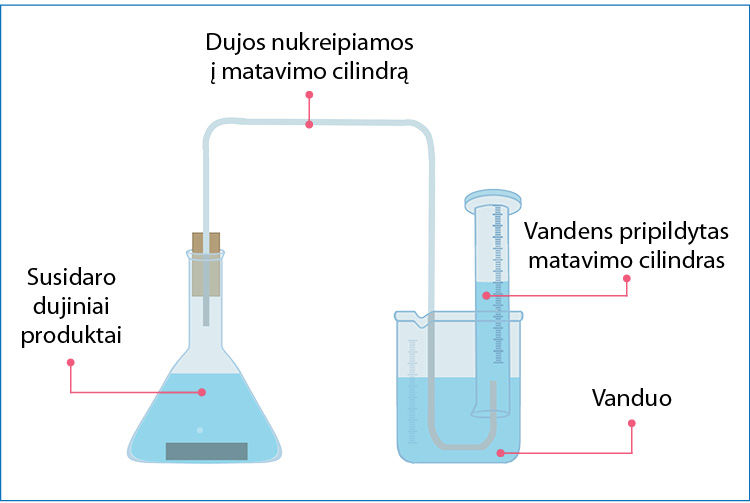
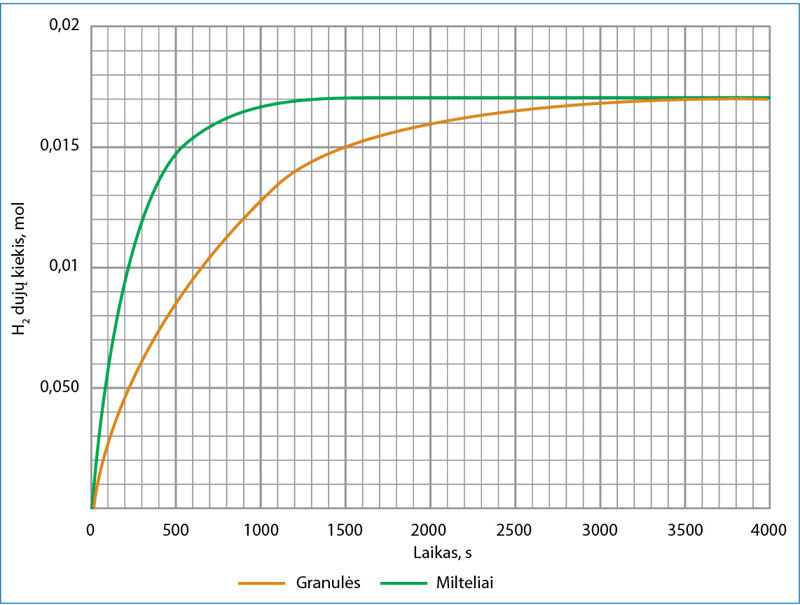
Į druskos rūgšties HCl(aq) tirpalą įdėjus cinko granulę, vandenilio jonai gali susidurti tik su cinko granulės paviršiuje esančiais atomais, todėl susidūrimų dažnis priklauso nuo metalo (cinko) paviršiaus ploto ir vandenilio jonų koncentracijos (6.2.3 pav.). Tai heterogeninė reakcija – reaguoja skirtingos agregatinės būsenos medžiagos. Apie cinko ir druskos rūgšties reakcijos greitį galima spręsti iš to, kaip sparčiai skiriasi vandenilio dujos. 6.2.4 paveiksle parodyta, kaip renkamos išsiskiriančios dujos, o 6.2.5 paveiksle – kaip didėja išsiskiriančio divandenilio kiekis, kai cinkas yra miltelių pavidalo (žalia kreivė) arba granulių pavidalo (oranžinė kreivė). Kuo labiau susmulkinta medžiaga, tuo jos paviršiaus plotas didesnis, tuo yra daugiau vietų, kuriose į cinko paviršių gali atsitrenkti vandenilio jonas, tuo sparčiau vyksta reakcija.
3 pavyzdys
Į dvi kolbas įpilta po 0,400 litro 1,00 mol/l druskos rūgšties HCl tirpalo. Į vieną kolbą įberta 11,05 g smulkių cinko miltelių, į kitą – tiek pat cinko granulių. Abi kolbos greitai užkimštos kamščiu su dujų tiekimo vamzdeliu. Dujos nukreiptos į dujų rinkimo cilindrus (6.2.4 pav.). Bandymo duomenys pateikti 6.2.5 paveiksle.
Apskaičiuokite:
- kiek pakito druskos rūgšties koncentracija atliekant vieną ir kitą bandymą per pirmąsias 300 sekundžių;
- kokiu vidutiniu greičiu vyko reakcija pirmąsias 300 sekundžių.
Sprendimas
Iš grafiko matome, kad 300 sekundę išsiskyrusio vandenilio kiekis vienu atveju buvo 0,0120 mol, kitu 0,0060 mol.
Reakcijos lygtis:
Zn(k) + 2HCl(aq) → ZnCl2(aq) + H2(d).
Įbėrus cinko miltelių,
n(H2) = 0,0120 mol.
HCl sureagavo:
x = 0,0240 mol;
Minuso ženklas todėl, kad HCl koncentracija mažėja.
Įbėrus cinko granulių,
n(H2) = 0,0060 mol.
y = 0,0120 mol;
Atsakymas:
- –0,0600 mol/l ir –0,0300 mol/l;
- 1,00 · 10–4 mol/(l · s) ir 5,00 · 10–5 mol/(l · s).
Klausimai ir užduotys
- Paaiškinkite, kodėl reakcijos greitis mažėja.
- Reakcijos
Cl2(d) + 2NO(d) → 2NOCl(d)
kinetinės lygties laipsnio rodikliai sutampa su šios cheminės lygties koeficientais.
- Parašykite šios reakcijos kinetinę lygtį.
Apskaičiuokite, kiek kartų pasikeis reakcijos greitis, jeigu:
- padvigubinsime Cl2 koncentraciją, bet nekeisime NO koncentracijos;
- padvigubinsime NO koncentraciją, bet nekeisime Cl2 koncentracijos;
- reaguojantį mišinį suspausime tiek, kad dvigubai sumažėtų jo tūris, t. y. dvigubai padidinsime ir Cl2, ir NO koncentraciją;
- trigubai padidinsime NO koncentraciją ir keturis kartus sumažinsime Cl2 koncentraciją.
- Dviejuose mėgintuvėliuose buvo vienodi tūriai vienodos koncentracijos druskos rūgšties tirpalo. Į vieną mėgintuvėlį įdėtas 0,5 g marmuro, t. y. CaCO3, gabaliukas, į kitą – 0,5 g sugrūsto marmuro. Kuriuo atveju reakcija vyksta sparčiau? Paaiškinkite, kodėl.
- Tiek 1-brombutanas (pažymėkime jį medžiaga A), tiek 2-brom-2-metilpropanas (pažymėkime jį medžiaga B) reaguoja su natrio hidroksidu. Vyksta pakaitų (pavadavimo) reakcija. Bromas pakeičiamas OH grupe.
Šių reakcijų kinetinės lygtys yra:
vA= kA· c(A) · c(OH–);
vB = kB · c(B) · c0(OH–).
Atkreipkite dėmesį, kad antruoju atveju hidroksido jonų koncentracija yra nuliniu laipsniu. Laipsnių rodiklių skirtumas susijęs su šių reakcijų mechanizmo skirtumais.
- Kiek kartų paspartės viena ir kita reakcija, jeigu abiem atvejais trigubai padidinsime ir halogenalkano, ir natrio hidroksido koncentraciją?
- Abiejų reakcijų greitis matuojamas mol/(l · s). Kokiais vienetais matuojama konstanta kA, kB?
- Aukštoje temperatūroje etano molekulės gali skilti:
C2H6(d) → C2H4(d) + H2(d).
Šios reakcijos kinetinė lygtis:
- Kiek kartų pasikeičia šios reakcijos greitis:
- 4 kartus padidinus etano koncentraciją;
- 9 kartus sumažinus etano slėgį?
- Nurodykite šios reakcijos greičio konstantos matavimo vienetus, jei greitis matuojamas mol/(l · s).
