Aktyvãcijos enèrgija, reãkcijos greičio temperatūrinis koeficieñtas, geomètrinė progrèsija, katalizãtorius, inhibitorius, fermeñtas.
Aktyvacijos energija
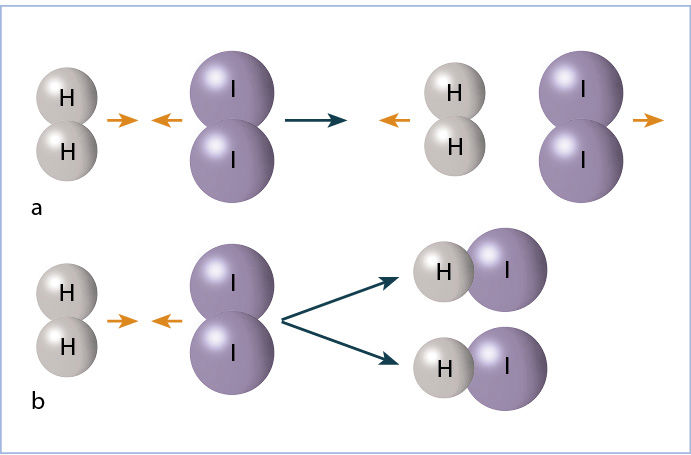
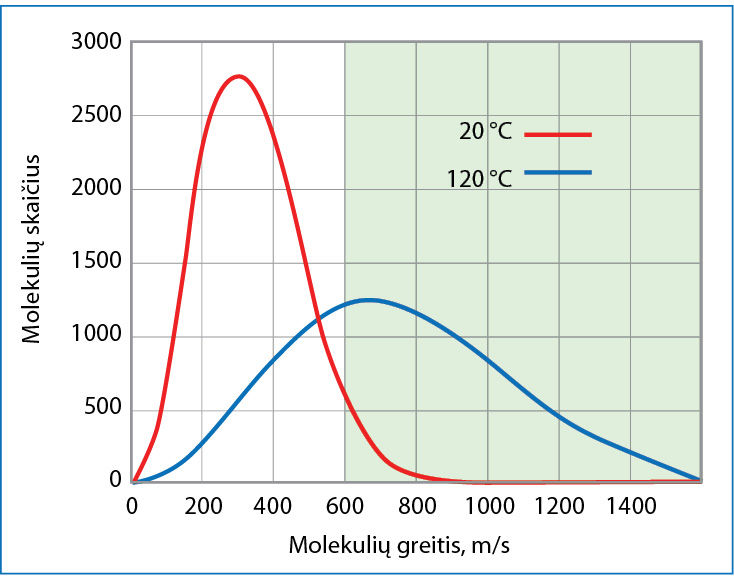
Kad įvyktų cheminė reakcija, molekulės (arba kitos dalelės) turi susidurti. Ne visi susidūrimai baigiasi chemine reakcija. Mažai energijos turinčios, lėtai judančios molekulės po smūgio viena į kitą gali paprasčiausiai atšokti kaip du kamuoliai. Jeigu dalelės juda greitai, smūgio viena į kitą energijos pakanka buvusiems ryšiams nutraukti, o šiems nutrūkus, gali susidaryti nauji ryšiai, naujos molekulės (6.3.1 pav.). Bet kuriame medžiagos mėginyje yra ir greitų, didelės kinetinės energijos, ir lėtų, mažos kinetinės energijos, molekulių. Mažiausia energija, kurios pakanka, kad atsitrenkusios viena į kitą dalelės sureaguotų, vadinama aktyvãcijos enèrgija Ea (su šia sąvoka jau susidūrėme nagrinėdami entalpijos pokyčius). Aktyvios, t. y. galinčios reaguoti, yra tik tos dalelės, kurių kinetinė energija lygi arba didesnė už Ea (6.3.2 pav.). Medžiagą kaitinant vidutinė dalelių kinetinė energija didėja, ir gausėja molekulių, kurių turima energija viršija aktyvacijos energiją. Vadinasi, gausėja galinčių reaguoti – aktyviųjų – molekulių dalis. Todėl didinant temperatūrą cheminės reakcijos spartėja.
Temperatūros įtaka reakcijos greičiui
Keliant temperatūrą aktyviųjų molekulių dalis sparčiai didėja. Todėl cheminės reakcijos greitis auga geometrine progresija. Šios progresijos vardiklis vadinamas reãkcijos greičio temperatūriniu koeficientù γ. Jis rodo, kiek kartų padidėja reakcijos greitis, temperatūrą pakėlus 10 °C.
(6.3.1)
čia
Daugelio cheminių reakcijų temperatūrinis koeficientas svyruoja tarp 1,5 ir 4.
1 pavyzdys
Vandenilio peroksido tirpalą rekomenduojama laikyti ne aukštesnėje nei 25 °C temperatūroje. Šioje temperatūroje jo skilimo greitis yra 3,0 · 10–5 mol/(l · s). Kokiu greičiu vyks vandenilio peroksido skilimas, jei temperatūra pakils iki 30 °C? Šios reakcijos temperatūrinis koeficientas lygus 1,8.
Sprendimas
γ = 1,8;
∆T = 30 °C – 25 °C = 5 °C;
Atsakymas: 4,0 · 10–5 mol/(l · s).
2 pavyzdys
Reakcijos 2NO(d) + O2(d) → 2NO2(d) temperatūrinis koeficientas lygus 2,2. Kiek kartų paspartėja ši reakcija, jeigu temperatūra padidinama nuo 25 °C iki 40 °C?
Sprendimas
γ = 2,2;
∆T = 40 °C – 25 °C = 15 °C.
Kiek kartų paspartėja reakcija, rodo greičių santykis
Atsakymas: 3,3 karto.
Greičio konstantos priklausomybė nuo temperatūros
Kai lyginame reakcijos greitį esant vienai ir kitai temperatūrai, reaguojančiųjų medžiagų koncentracija abiem atvejais turi būti tokia pati. 2 pavyzdyje nagrinėtos reakcijos kinetinė lygtis:
Jeigu abiem bandymams naudojamos tokios pat koncentracijos medžiagos, reakcijos greitis gali paspartėti tik dėl greičio konstantos didėjimo. Ši konstanta priklauso nuo temperatūros. Reakcijos greitis paspartėja tiek kartų, kiek padidėja greičio konstanta. Todėl lygtį (6.3.1) galime perrašyti kitaip:
(6.3.2)
Katalizatoriai
Katalizãtoriais vadinamos medžiagos, dėl kurių pakinta cheminės reakcijos greitis. Dažniausiai katalizatoriaus sąvoka siejama su reakcijos spartinimu. Tačiau gali būti ir reakcijas lėtinančių medžiagų. Jos vadinamos neigiamais katalizãtoriais, arba inhibitoriais. Vykstant reakcijai katalizatoriaus kiekis nepakinta. Kiek jo sureaguoja vienoje reakcijos stadijoje, tiek pat jo pasigamina kitoje.
3 pavyzdys
Gaminant sieros rūgštį bene sudėtingiausia yra iš sieros(IV) oksido pagaminti sieros(VI) oksidą. Pirmiau šiam virsmui taikytas metodas, kurį cheminėmis lygtimis galime parašyti taip:
NO(d) +
NO2(d) + SO2(d) → SO3(d) + NO(d).
- Nurodykite, kas šiuo atveju yra reaguojančioji (-iosios) medžiaga (-os), produktas (-ai), katalizatorius (-iai).
- Sudėkite abi chemines lygtis ir parašykite suminę lygtį.
Sprendimas
- Kiek pirmojoje reakcijoje sunaudojama NO, tiek pat jo pasigamina antrojoje. Šis oksidas yra katalizatorius.
SO2 ir O2 sunaudojami, tad tai – reaguojančiosios medžiagos, o SO3 yra reakcijos produktas. Jo kiekis didėja.
- Suminė lygtis:
Suprastinus besikartojančias medžiagas, lieka:
Sieros(IV) oksidas tiesiogiai reaguoja su deguonimi, sudarydamas sieros(VI) oksidą. Šios reakcijos aktyvacijos energija didelė, todėl tik nedaugelis molekulių turi pakankamai energijos aktyvacijos barjerui įveikti. Tiesioginės oksidacijos reakcija yra lėta. Abiejų 3 pavyzdyje nagrinėjamų reakcijų aktyvacijos energija yra gerokai mažesnė, negu tiesioginės sieros(IV) oksido oksidacijos reakcijos (6.3.3 pav.). Todėl per dvi stadijas vykstantis procesas yra spartesnis negu tiesioginis. Sakoma, kad katalizatorius sumažina proceso aktyvacijos energiją. Reakcija vyksta per daugiau stadijų, bet kiekvienos iš stadijų aktyvacijos energija mažesnė negu reakcijos be katalizatoriaus.
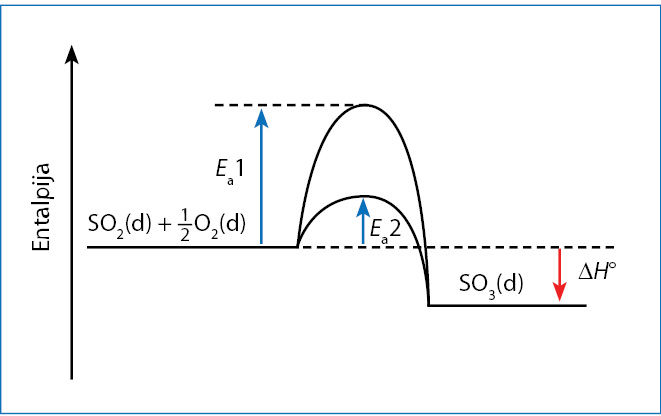
3 pavyzdyje tiek katalizatorius, tiek reaguojančiosios medžiagos yra dujos, kurios sudaro vienalytį (homogeninį) mišinį. Tokie katalizatoriai vadinami homogèniniais. Dažnai naudojami kietieji katalizatoriai (pavyzdžiui, pereinamieji metalai, metalų oksidai). Tai heterogèniniai katalizãtoriai. Spartinamoji reakcija vyksta į tokio katalizatoriaus paviršių atsitrenkus reaguojančiųjų medžiagų molekulėms. Heterogeniniai katalizatoriai patogūs tuo, kad jų nereikia išskirti iš reakcijos mišinio. Galima pastoviu greičiu leisti reaguojančiąsias dujas ar tirpalus pro reaktorių, kuriame yra kietasis katalizatorius. Taip gamyba gali vykti nenutrūkstamai.
Praktikoje naudojami ir reakcijas spartinantys katalizatoriai, ir inhibitoriai. Pavyzdžiui, jeigu reikia iš vandenilio peroksido pasigaminti deguonies dujų, galima naudoti mangano dioksido MnO2 katalizatorių. Jis labai paspartina vandenilio peroksido skilimo reakciją, o fosforo rūgštis šią reakciją lėtina.
Fermentai
Beveik visos organizmo reakcijos vyksta dalyvaujant vienokiems ar kitokiems katalizatoriams, kurie vadinami fermeñtais. Dažniausiai tai būna baltymai. Jei organizme trūksta kokio nors fermento, pasireiškia sveikatos sutrikimų. Pavyzdžiui, dalis žmonių neturi pieno cukrų – laktozę – skaidančio fermento laktazės, todėl išgėrus pieno sutrinka virškinimas. Tačiau fermentuotus pieno produktus (brandintą sūrį, kefyrą) tokie žmonės vartoti gali, nes fermentuojant šiuos produktus laktozė suskaidoma.
Fermentai naudojami gaminant sūrį. Pramoniniu mastu spaudžiant vaisių sultis, fermentais suardomos ląstelių sienelės, todėl padidėja sulčių išeiga. Net skalbimo priemonėse yra fermentų priedų. Farmacijos pramonėje fermentai naudojami gaminant įvairius vaistus.
Padidinta temperatūra, labai žema arba labai aukšta pH reikšmė, kai kurios medžiagos gali suardyti baltymo struktūrą, jį denatūruoti, todėl fermentas pasidarys neveiksmingas. Visi su fermentų naudojimu susiję procesai atliekami laikantis tam tikro temperatūrinio režimo, vengiant kitų baltymus denatūruojančių veiksnių.
Klausimai ir užduotys
- Apibrėžkite, ką vadiname aktyvacijos energija.
- Paaiškinkite, kodėl keliant temperatūrą didėja cheminės reakcijos greitis.
- Į vandenilio peroksido tirpalą įdėjus žalių kepenų gabaliuką, prasideda sparti skilimo reakcija, skiriasi deguonies dujos. Įdėję virtų kepenų, jokių pokyčių nematome. Paaiškinkite, kodėl.
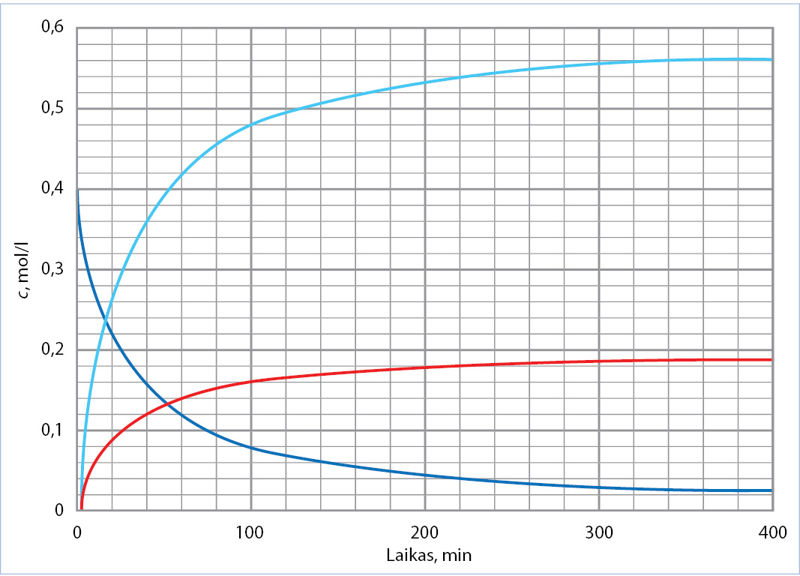
- Kaitinamas amoniakas skyla. 1-ajame paveiksle parodytas koncentracijos kitimas vykstant reakcijai:
2NH3(d) → N2(d) + 3H2(d).
- Kuri kreivė kurios medžiagos koncentracijos kitimą rodo?
- Kokią koncentraciją praėjus 220 min nuo reakcijos pradžios rodo raudona ir šviesiai mėlyna kreivės? Koks yra šių koncentracijų santykis? Paaiškinkite, kaip šis santykis susijęs su reakcijos lygtimi.
- Koks yra vidutinis amoniako skilimo reakcijos greitis per pirmąsias 100 min? Parodykite, kaip reikia atlikti skaičiavimus, kad tą pačią greičio skaitinę vertę gautume skaičiuodami pagal kiekvieną iš duotų kreivių.
- Parašykite, kokia būtų galutinė azoto ir vandenilio koncentracija, jeigu suskiltų visas amoniakas.
- Nubraižykite grafiko eskizą, kuriuo būtų parodyta, kaip kinta skylančio amoniako koncentracija, jeigu reakcija vyksta:
- nenaudojant katalizatoriaus;
- pridėjus katalizatoriaus.