Santrauka
Cheminė kinetika yra chemijos šaka apie reakcijų greitį.
Cheminės reakcijos greitis apibrėžiamas kaip
Reakcijos greitis matuojamas molinės koncentracijos pokyčiu per pasrinktą laiko intervalą, pavyzdžiui, mol/(l · s), mol/(dm3 · s), kmol/(m3 · h), ir kitais ekvivalenčiais matais. Kartais gali būti išreikštas, masės koncentracijos pokyčiu per laiko tarpsnį, kaip antai g/(l · s).
Reakcijos greičio priklausomybę nuo medžiagų koncentracijos rodo kinetinė lygtis. Šios lygties laipsnio rodikliai nustatomi atliekant bandymus. Paprastai jie nesutampa su lygties koeficientais.
Kinetinės lygties laipsnio rodikliai dažniausiai būna nedideli sveikieji skaičiai (1 arba 2). Esant sudėtingam reakcijos mechanizmui, gali būti trupmeniniai laipsnio rodikliai (pvz.,
Reakcijos greičio konstantos k matavimo vienetai skirtingų reakcijų gali būti skirtingi. Jie priklauso nuo kinetinėje lygtyje įrašytų koncentracijų laipsnio rodiklių sumos.
Jei reaguoja kietoji medžiaga ir ištirpinta medžiaga, t. y. vyksta heterogeninė reakcija, jos greitis priklauso nuo kietosios medžiagos paviršiaus ploto ir ištirpintos medžiagos koncentracijos.
Dujų slėgis proporcingas koncentracijai. Kinetinėje lygtyje vietoj koncentracijos gali būti vartojamas dujų slėgis. Tokiu atveju reakcijos greitis būtų išreiškiamas slėgio pokyčiu per laiko intervalą.
Sureaguoti gali tik tos molekulės (arba kitos dalelės), kurių kinetinė energija yra lygi arba didesnė už aktyvacijos energiją Ea. Keliant temperatūrą tokių molekulių dalis didėja ir reakcija spartėja.
Reakcijos greičio priklausomybė nuo temperatūros aprašoma lygtimi
Katalizatoriai didina, inhibitoriai (neigiamieji katalizatoriai) mažina reakcijos greitį. Vykstant reakcijai katalizatorių ir inhibitorių kiekis nekinta.
Praktinė užduotis
Reakcijos kinetikos tyrimas
Tirsime reakciją:
Na2S2O3(aq) + 2HCl(aq) → 2NaCl(aq) + SO2(d) + S(k) + H2O(s).
Reikės
0,10 mol/l natrio tiosulfato Na2S2O3(aq) tirpalo, 0,10 mol/l druskos rūgšties HCl(aq) tirpalo, 100 ml cheminės stiklinės (1 vnt.), 50 ml cheminių stiklinių (2 vnt.), nedidelio popieriaus lapelio su piešiniu, laikmačio (galima naudoti telefono laikmatį arba lėtai skaičiuoti, kol pamatysite stebimą efektą).
Vykstant reakcijai išsiskiria smulki siera S(k), todėl tirpalas susidrumsčia. Ant popieriaus lapelio nupieškite kokią nors figūrą. Ant popieriaus su piešiniu padėkite 100 ml cheminę stiklinę taip, kad piešinys būtų po stikline, jos dugno centre. Atlikdami tyrimą į šią stiklinę supilsite tiriamuosius tirpalus, greitai įjungsite laikmatį ir stebėsite iš viršaus, per kiek laiko tirpalas susidrumsčia tiek, kad beveik nebematyti piešinio. Kiekvieną kartą stenkitės stabdyti laikmatį esant tokiam pačiam tirpalo drumstumui (tokiam pačiam stebimo piešinio po stikline matomumui).
1 lentelė
Bandymo Nr. | Į pirmąją 50 ml cheminę stiklinę pilama: | Į antrąją 50 ml cheminę stiklinę pilama: | Laikas, per kurį išnyko vaizdas, sekundėmis | ||
0,10 mol/l | vandens | 0,10 mol/l HCl tirpalo | vandens | ||
1 | 10 ml | 10 ml | 10 ml | 10 ml | |
2 | 20 ml | - | 10 ml | 10 ml | |
3 | 10 ml | 10 ml | 20 ml | - | |
4 | 20 ml | - | 20 ml | - | |
Tyrimo žingsniai
1-ojoje lentelėje parodyta, kaip kiekvienam bandymui paruošiami pradiniai tirpalai. 50 ml cheminėse stiklinėse paruoškite pirmojo bandymo tirpalus. Jeigu dirbate poromis, vienas iš jūsų abu tirpalus iš 50 ml stiklinių turi supilti į 100 ml stiklinę (pilkite tirpalus vienu metu, vieną stiklinę laikydami vienoje rankoje, o kitą kitoje). Tirpalą 100 ml stiklinėje pamaišykite sukdami stiklinę rankoje, padėkite atgal ant piešinio ir daugiau nejudinkite. Kitas bandymo dalyvis turi įjungti laikmatį tuo momentu, kai tirpalai iš mažesniųjų stiklinių tik pradedami pilti į didesniąją. Stebėkite tirpalą iš viršaus ir, kai atrodys, kad piešinys tuoj bus nebematomas, sustabdykite laikmatį. Užsirašykite duomenį, išplaukite ir iššluostykite 100 ml stiklinę, tada atlikite kitus bandymus. Reaguojant skiriasi troškios sieros(IV) oksido dujos, todėl po kiekvieno bandymo atliekas patartina supilti į uždaromą konteinerį.
Duomenų analizė
- Apskaičiuokite natrio tiosulfato Na2S2O3 ir vandenilio chlorido HCl molinę koncentraciją 100 ml stiklinėje tirpalų sumaišymo momentu. Nepamirškite, kad skiedžiant vandeniu ir supilant du tirpalus iš mažesniųjų stiklinių į didesniąją, didėja mišinio tūris, vadinasi, mažėja tirpinio koncentracija.
- Linijiniam grafikui sudaryti turėsite per mažai duomenų, tad sudarykite stulpelines diagramas, kuriomis parodysite, kaip keičiasi laikas iki vaizdo išnykimo, priklausomai nuo vienos ir kitos medžiagos koncentracijos.
- Užbaikite teiginį „Kuo reakcija vyksta sparčiau, tuo laikas iki vaizdo išnykimo yra .......................... (trumpesnis / ilgesnis).“
- Ar vienodą įtaką reakcijos greičiui turi vienos ir kitos reaguojančiosios medžiagos koncentracijos padidinimas? Jeigu nevienodą, kurios iš medžiagų įtaka didesnė?
- Tiriamosios reakcijos kinetinė lygtis yra:
v=k\cdot c^x\left(\mathrm{Na_2S_2O_3}\right)\cdot c^{\gamma}\mathrm{\left(\mathrm{HCl}\right)}.
Remdamiesi duomenų analizės 2–4 žingsnių pastebėjimais, įvertinkite, kuriuo atveju teisingai nurodyti laipsnio rodikliai x ir y. Paaiškinkite, kaip pasirinkote atsakymą.- x = 1; y = 1
- x = 1; y = 2
- x = 2; y = 1
- x = 2; y = 2
- Tarkime, kad piešinio vaizdas išnyksta tada, kai jūsų stiklinėje susidaro 4,0 · 10–4 mol sieros. Apskaičiuokite vidutinį reakcijos greitį iš kiekvieno bandymo duomenų.
- Kaip pasikeistų jūsų registruotas laikas, jeigu tyrimas būtų atliekamas su didesnės temperatūros tirpalais? Atsakymą paaiškinkite.
Papildomos užduotys
- Reakcijos A(d) → B(d) + C(d) kinetinė lygtis . Kai medžiagos A koncentracija sudarė 0,50 mol/dm3, jos greitis buvo 3,5 mol/(dm3 · h).
- Paaiškinkite, ką rodo reakcijos greitis.
- Kokiu atveju reakcijos greitis ir greičio konstanta skaitine verte sutampa?
- Kokia yra šios reakcijos greičio konstanta (skaitinė vertė ir matavimo vienetai)?
- Kiek kartų reikia padidinti slėgį, kad reakcija vyktų 9 kartus sparčiau?
- Kalcio karbonato CaCO3(k) ir druskos rūgšties HCl(aq) reakcija tirta stebint masės kitimą (1 pav.). Matavimo duomenys pateikti lentelėje.
- Sudarykite masės priklausomybės nuo laiko grafiką.
- Apskaičiuokite per pirmąsias 50 s išsiskyrusio anglies(IV) oksido kiekį (mol) ir tūrį (litrais) standartinėmis sąlygomis.
- Pasibaigus reakcijai kolboje nebeliko kalcio karbonato. Apskaičiuokite į kolbą įdėto kalcio karbonato masę.
- Prieš pradedant bandymą kolboje buvo 0,300 litro tirpalo, kuriame HCl koncentracija 1,45 mol/l. Kiek molių vandenilio chlorido lieka kolboje pasibaigus reakcijai?
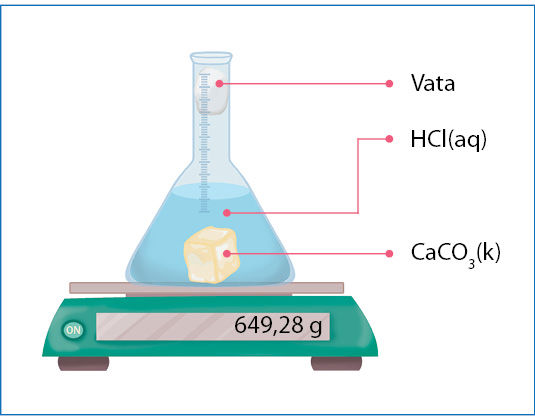
Laikas, s | 0 | 20 | 40 | 60 | 120 | 180 | 240 | 300 |
Kolbos su medžiagomis masė, g | 649,28 | 646,85 | 645,31 | 644,34 | 643,10 | 642,79 | 642,71 | 642,71 |
- Dujinis azoto(V) oksidas skyla taip:
2N2O5(d) → 4NO2(d) + O2(d).
Sudarykite grafiko eskizą, kuriuo būtų parodyta reaguojančiųjų medžiagų ir reakcijos produktų koncentracijos priklausomybė nuo laiko. Pasinaudokite 1 paveikslo pavyzdžiu. Laikykite, kad pradinė azoto(V) oksido koncentracija buvo 0,20 mol/l. Laiko skalėje, žinoma, konkrečių skaičių nurodyti nereikia, pažymėkite tik ašies pavadinimą „laikas“.
- Dujinis nitrozilo chloridas skyla taip:
2NOCl(d) → 2NO(d) + Cl2(d).
Sudarykite grafiko eskizą, kuriuo būtų parodytas apytikslis reaguojančiųjų medžiagų ir reakcijos produktų koncentracijos kitimas vykstant reakcijai. Pasinaudokite 1 paveikslo pavyzdžiu. Laikykite, kad pradinė nitrozilo chlorido koncentracija buvo 0,30 mol/l. Laiko skalėje pažymėkite tik ašies pavadinimą „laikas“, konkrečių skaičių nurodyti nereikia.
- Malūnuose susidaro sprogusis miltų dulkių ir oro mišinys. Siekiant išvengti sprogimų, patalpos yra ventiliuojamos, naudojama nekibirkščiuojanti elektros įranga. Paprastai miltų nelaikome pavojinga, sprogia medžiaga. Paaiškinkite, kodėl malūnuose miltai gali sukelti sprogimą.
- Reakcijos greitis 5,5 mol/(l · s). Išreikškite šį greitį tokiais matais:
- mol/(l · min);
- mol/(dm3 · s);
- mol/(m3· min);
- kmol/(m3· h).
- Reakcijos greičio konstanta yra 4,0 l/(mol · s). Išreikškite šią konstantą ml/(mol · s).
- Reakcijos greičio konstanta yra 5,0 l/(mol · s). Išreikškite šią konstantą ml/(mol · min).
- Reakcijos greičio konstanta yra 3,0 l2/(mol2 · s). Išreikškite šią konstantą l2/(kmol2 · h).
- Reakcijos greičio konstanta yra 3,0 l2/(mol2 · s). Išreikškite šią konstantą m6/(kmol2 · h).
- Kuris teiginys apie reakcijos greičio konstantą teisingas?
- Ji kinta keičiant temperatūrą arba įdedant katalizatoriaus.
- Ji priklauso nuo medžiagų koncentracijos, o šioms mažėjant, kinta ir konstanta.
- Ji kinta keičiantis ir koncentracijai, ir temperatūrai.
- Ji kinta tik įdėjus katalizatoriaus.
- Reakcijos
2N2O5(d) → 4NO2(d) + O2(d)
kinetinė lygtis yra:
v = k · c(N2O5).
25 °C temperatūroje, kai azoto(V) oksido koncentracija yra 1,5 · 10–2 mol/l, skilimo reakcijos greitis yra 4,5 · 10–4 mol/(l · min).
- Apskaičiuokite šios reakcijos greičio konstantą (skaitinę vertę ir matavimo vienetus).
- Kokiu greičiu vyks reakcija, kai azoto(V) oksido koncentracija sumažės iki 8,2 · 10–3 mol/l?
- Šios reakcijos temperatūrinis koeficientas γ = 3,8. Kokiu greičiu vyktų reakcija, jeigu temperatūra būtų 45 °C, o azoto(V) oksido koncentracija 1,0 · 10–2 mol/l?
- Vandenilio peroksidas skyla lėtai, todėl paėmę į rankas buteliuką su šiuo preparatu nepajausime temperatūros pokyčio. Įdėjus katalizatoriaus, reakcija gerokai paspartėja. Palietus indą, kuriame vyksta ši reakcija, jaučiama, kad tirpalo temperatūra yra didesnė už aplinkos.
- Koks yra šios reakcijos entalpijos pokytis ∆H° – teigiamas ar neigiamas?
- Kokia yra ši reakcija – endoterminė ar egzoterminė?
- Tik įdėję katalizatoriaus, pamatome dujų išsiskyrimą. Po kurio laiko pastebime, kad reakcija spartėja. Kaip paaiškinti šį reakcijos spartėjimą?
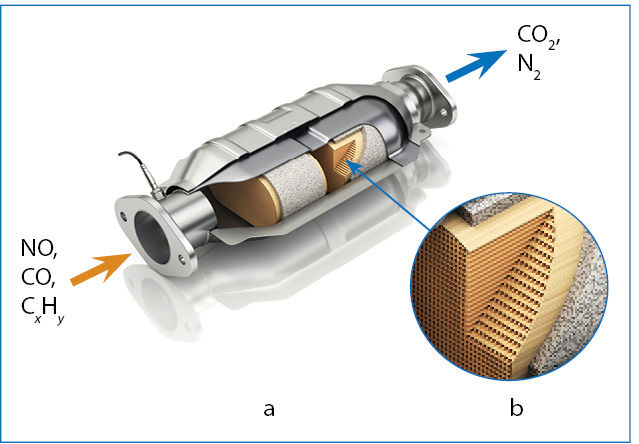
- Automobilio variklyje oksiduojamas suslėgtas dujinių degalų ir oro mišinys. Idealiu atveju degimo produktai turėtų būti tik anglies dioksidas ir vanduo. Tačiau dėl aukštos temperatūros ir slėgio susidaro šiek tiek azoto oksidų. Dalis degalų sudega nevisiškai, todėl susidaro įvairių dalinio degimo produktų CxHy ir anglies monoksidas CO. Šių teršalų kiekiui sumažinti automobilių dujų išmetimo sistemoje montuojami kataliziniai konverteriai (2 pav.). Iš automobilio variklio dujos patenka į konverterį, kuriame yra tauriųjų metalų (platinos, iridžio, rodžio) katalizatorių. Vienoje konverterio dalyje redukuojami azoto oksidai, susidaro nekenksmingas azotas N2. Kitose dalyse oksiduojami CxHy ir CO, susidaro anglies dioksidas ir vanduo. Taip sumažinamas į aplinką patenkančių teršalų kiekis.
- Katalizatoriai būna homogeniniai ir heterogeniniai. Kuriai grupei priklauso automobilių konverteriuose naudojami katalizatoriai?
- Keraminis blokas, kurio paviršius padengtas katalizatoriais, yra korio pavidalo, su daugybe mažo skersmens kanalų. Kodėl jis daromas toks akytas, o ne ištisinis?
- Automobilio katalizinio konverterio veiksmingumą reikia tikrinti tik tada, kai automobilis yra paleistas ilgesnį laiką ir konverteris yra įšilęs. Paaiškinkite, kodėl.
- Kuo pavojingas degimo produktuose esantis anglies monoksidas CO?
- Kuo pavojingi degimo produktuose esantys azoto oksidai NO ir NO2?
- Reakcijos 2NO(d) + O2(d) → 2NO2(d) kinetinė lygtis yra v = k · c2(NO) · c(O2).
- Kiek kartų pasikeis reakcijos greitis?
- 3 kartus padidinus NO koncentraciją ir 3 kartus sumažinus O2 koncentraciją;
- 3 kartus padidinus O2 koncentraciją ir 3 kartus sumažinus NO koncentraciją;
- Suslėgus dujas taip, kad mišinio tūris sumažėja 3 kartus.
- Koncentracija matuojama mol/l, o reakcijos greitis mol/(l · min). Kokie yra nagrinėjamos reakcijos greičio konstantos matavimo vienetai?
- Ar visų reakcijų greičio konstantų matavimo vienetai yra tokie, kokius nurodėte b) dalyje?
- Kiek kartų pasikeis reakcijos greitis?
- Termocheminė vandenilio peroksido skilimo reakcija:
2H2O2(aq) → 2H2O(s) + O2(d); ∆H° = –189 kJ.
Šios reakcijos aktyvacijos energija be katalizatoriaus yra 75 kJ/mol, o su platinos katalizatoriumi – 49 kJ/mol.
- Sudarykite energinę šios reakcijos diagramą (pasinaudokite 6.3.3 paveikslu), pažymėdami pradinių ir galutinių medžiagų energijos būsenas, energijos barjerą (su katalizatoriumi ir be jo) bei entalpijos pokytį. Diagramoje parašykite užduotyje nurodytų dydžių skaitines vertes.
- Įdėjus katalazės (fermento), vandenilio peroksido skilimo aktyvacijos energija yra 8 kJ/mol. Kuris katalizatorius labiau paspartina nagrinėjamą reakciją – platina ar katalazė? Atsakymą paaiškinkite.
