Trumpiausią vasaros naktį degantys Joninių laužai – tik vienas iš oksidacijos-redukcijos reakcijos pavyzdžių. Deginama medžiaga reaguoja su deguonimi. Iš šio elemento lotyniškojo pavadinimo – oxygenium – atsirado terminas „oksidacija“. Pažodžiui tai reiškia jungimąsi su deguonimi. Išsiaiškinus, kad degant medienai, rūdijant geležiai, kvėpuojant deguonies atomai įgyja papildomų elektronų, oksidacija pradėta vadinti visus cheminius procesus, susijusius su elektronų perėjimu iš vienos dalelės į kitą. Elektronų netenkančios dalelės imtos vadinti reduktoriais, o juos prisijungiančios – oksidatoriais. Oksidacija ir redukcija visada vyksta kartu.

Išnagrinėję šį skyrių, gebėsite:
- nustatyti, kas yra oksidatorius, o kas reduktorius;
- išlyginti sudėtingas oksidacijos-redukcijos reakcijų lygtis;
- nustatyti, kurie metalai reaguoja su vandeniu, rūgštimis ar druskomis;
- apibūdinti elektrolizės procesus, nurodyti elektrolizės produktus;
- paaiškinti, kas yra metalų korozija, ir pasiūlyti apsaugos nuo korozijos būdus.
Oksidacijos-redukcijos reakcijų lyginimas
Oksidãcijos láipsnio apskaičiãvimo taisỹklės, oksidãtorius, redùktorius, dalinė lygtis.
Oksidacijos-redukcijos reakcijų lyginimas
Vykstant mainų reakcijoms, elementų elektroninė sandara ir oksidacijos laipsnis nekinta. Oksidacijos-redukcijos reakcijos susijusios su elektronų perėjimu iš dalelės į dalelę ir elementų oksidacijos laipsnių pokyčiu.

1 pavyzdys
Stiprūs oksidatoriai (pavyzdžiui, kalio permanganatas KMnO4) rūgščioje terpėje chlorido jonus paverčia chloro molekulėmis. Išlyginkite reakcijos lygtį:
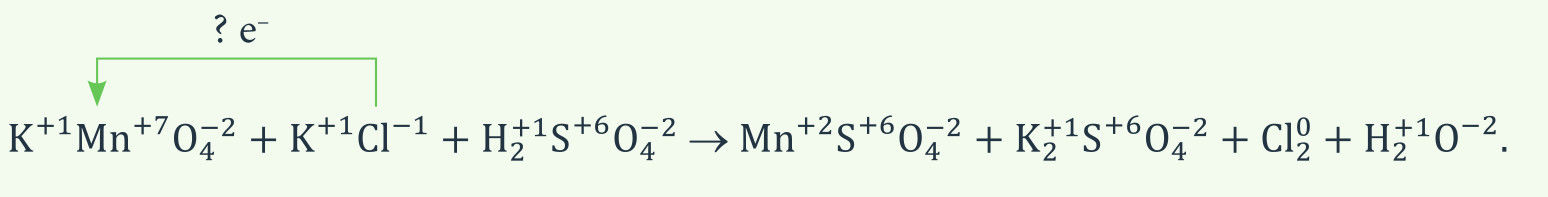
Sprendimas
Lygtyje jau nurodyti oksidacijos laipsniai. Jei reikia, pasikartokite oksidacijos laipsnio apskaičiavimo taisykles (žr. 4.2 temą). Matome, kad kinta mangano ir chloro oksidacijos laipsniai. Kitimus užrašysime dalinėmis lygtimis.
(Mn+7 yra oksidatorius, tai – redukcijos dalinė lygtis);
(Cl– yra reduktorius, tai – oksidacijos dalinė lygtis);
(dalinių lygčių suma).
Mangano Mn+7 prisijungtų ir chlorido Cl– netektų elektronų skaičius turi sutapti, todėl antroji dalinė lygtis padauginta iš 5. Iš suminės lygties matome, kad Mn+7 ir Cl– koeficientų santykis turi būti 1 : 5. Tam, kad išvengtume trupmeninio koeficiento prie Cl2 formulės, verta suminę lygtį padvigubinti.
Ši suminė lygtis yra užduotyje nurodytos lygties „griaučiai“ – rodo tik oksidatoriaus ir reduktoriaus koeficientų santykį. Ja remdamiesi galime išlyginti užduotyje pateiktą lygtį.
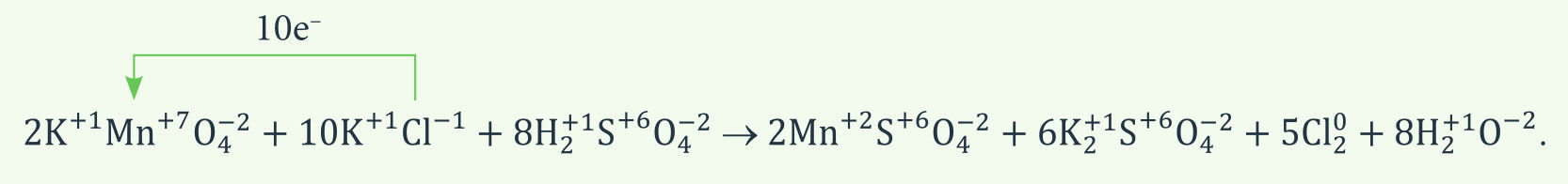
Kalio permanganatas sudarytas iš kalio jonų K+ ir permanganato jonų
Suprastinę nepakitusius, nereaguojančius jonus, gauname sutrumpintąją joninę lygtį:
Oksidatorius redukuojasi, reduktorius oksiduojasi
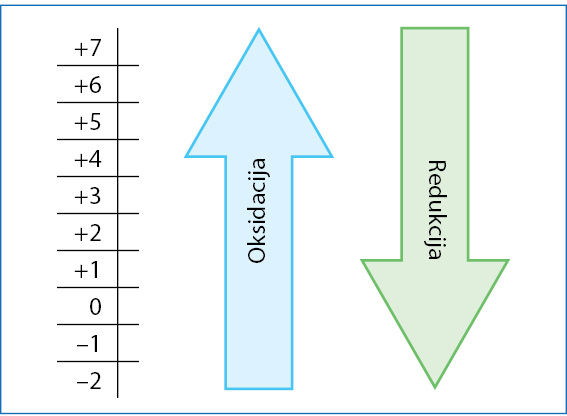
Šios sąvokos gali būti painiojamos, jei nesusiejame jų prasmės. Lotyniškas žodis reductio1 reiškia mažinimą. Tad reduktorius – tai mažintojas. Atiduodamas elektronus (žr. 1 pavyzdį), Cl– jonas mažina mangano oksidacijos laipsnį, jis yra mažintojas (reduktorius). Mangano oksidacijos laipsnio kitimas nuo +7 iki +2 yra mažėjimas (redukcija). (7.1.2 pav.)
1 Iš šio žodžio kilęs anglų kalbos veiksmažodis to reduce – mažinti.
2 pavyzdys
Išlyginkite oksidacijos-redukcijos lygtį. Nurodykite oksidatorių ir reduktorių bei kuris procesas yra redukcija, o kuris – oksidacija.
K2Cr2O7 + HI → I2 + KI + CrI3 + H2O.
Sprendimas
Apskaičiavę visų elementų oksidacijos laipsnius, pastebėsime, kad keičiasi chromo ir jodo oksidacijos laipsnis. Sudarome dalines lygtis, parenkame daugiklius ir sudedame jas.
(Cr+6 yra oksidatorius, vyksta redukcijos procesas);
(I– yra reduktorius, vyksta oksidacijos procesas);
Siekdami išvengti trupmeninių koeficientų, suminę lygtį padauginkime iš dviejų:
2Cr+6 + 6I– → 2Cr+3 + 6I0.
Išlyginta lygtis:
K2Cr2O7 + 14HI → 3I2 + 2KI + 2CrI3 + 7H2O.
Atkreipkite dėmesį, kad priešais HI yra koeficientas 14, o ne 6. Taip nutiko todėl, kad dalis jodido jonų nekeičia oksidacijos laipsnio. Dešinėje lygties pusėje kalio jodide ir chromo(III) jodide lieka 8 nepakitusio oksidacijos laipsnio jodido jonai. Vadinasi, 6 jodido jonai keičiasi, o 8 nesikeičia. Todėl priešais HI yra suminis koeficientas 6 + 8 = 14.
2 pavyzdyje išnagrinėtą lygtį perrašę sutrumpintąja jonine lygtimi, gauname:
Tad realus oksidatoriaus savybėmis pasižymintis jonas yra dichromato jonas
Populiariausi oksidatoriai ir reduktoriai
7.1 lentelėje rasite dažniausių oksidatorių ir reduktorių pavyzdžių. Vieningų oksidacines-redukcines savybes nusakančių taisyklių nėra. Galime pastebėti tik pačius bendriausius dėsningumus. Mažiausio oksidacijos laipsnio elementai gali tik netekti elektronų, t. y. gali būti tik reduktoriais, pavyzdžiui, Cl–1. Didžiausio oksidacijos laipsnio elementai gali tik prisijungti elektronų, t. y. būti tik oksidatoriais, pavyzdžiui, Mn+7.
7.1 lentelė. Dažniausiai pasitaikantys reduktoriai ir oksidatoriai
| Reduktoriai | Oksidatoriai |
Vieninės medžiagos | Periodų pradžios elementai: aktyvieji metalai (šarminiai ir šarminių žemių metalai: Na, Ca ir kt). Divandenilis H2. | Periodų pabaigos elementai – nemetalai: halogenai (F2, Cl2, Br2, I2), dideguonis O2 ir trideguonis O3. |
Reduktorius yra žemiausio, o oksidatorius – didžiausio oksidacijos laipsnio elementas | H–1: aktyviųjų metalų hidridai (pvz., NaH, CaH2, kuriuose vandenilis yra žemiausio oksidacijos laipsnio, t. y. –1). | N+5: azoto rūgštis HNO3 ir nitratai (pvz., KNO3). |
Kitų junginių pavyzdžiai | Natrio tiosulfatas Na2S2O3, etanalis CH3CHO, C, CO. | Peroksidai: vandenilio H2O2, natrio Na2O2. |
Pereinamųjų elementų panašumas į pagrindinių grupių elementus
Išnagrinėtuose 1 ir 2 pavyzdžiuose oksidatoriai buvo pereinamieji elementai manganas ir chromas. Nors pereinamųjų grupių elementai yra metalai, jie gali sudaryti nemetalams būdingus junginius. 6-osios grupės elemento chromo ir 16 grupės sieros didžiausias oksidacijos laipsnis yra +6. Jie sudaro rūgštinius oksidus CrO3 ir SO3, rūgštis H2CrO4 (chromato rūgštis) ir H2SO4 (sulfato rūgštis) bei druskas, pavyzdžiui, K2CrO4 (kalio chromatas) ir K2SO4 (kalio sulfatas). Chromui dar būdinga sudaryti dimerizuotas druskas, pvz., kalio dichromatą K2Cr2O7.
7-osios ir 17-osios grupių grupės elementų didžiausias oksidacijos laipsnis yra +7. Būdami šio oksidacijos laipsnio, jie sudaro panašius junginius, pavyzdžiui, Cl2O7 ir Mn2O7 yra rūgštiniai oksidai, iš kurių susidaro perchlorato HClO4 ir permanganato HMnO4 rūgštys bei druskos KClO4 (kalio perchloratas) ir KMnO4 (kalio permanganatas).
Klausimai ir užduotys
- Pagrindinė gamtinių dujų sudedamoji dalis – metanas – dega:
CH4(d) + 2O2(d) → CO2(d) + 2H2O(s);
∆H° = –890 kJ.- Pagal oksidacijos laipsnio kitimus, tai – oksidacijos-redukcijos reakcija. Kaip ji vadinama pagal šiluminį efektą?
- Sudarykite dalines lygtis ir nurodykite, kuris elementas yra oksidatorius, o kuris reduktorius; kuris procesas yra oksidacija, o kuris – redukcija.
- Kiek molių elektronų dalyvauja reakcijoje, jeigu sudega 1,0 mol metano?
- Kiek gramų metano sudeginus išsiskiria 5,0 MJ šilumos?
- Žemiau parašytos kelios cheminių reakcijų lygtys. Kuri šių reakcijų nėra oksidacijos-redukcijos? Kitos dvi reakcijos yra oksidacijos-redukcijos. Parašykite jų dalines lygtis, nurodykite oksidatorių ir reduktorių.
- 2Na + Br2 → 2NaBr;
- Na2CO3 + 2HCl → 2NaCl + CO2 + H2O;
- NaH + H2O → NaOH + H2.
- Išlyginkite reakcijų lygtis. Nurodykite oksidatorių ir reduktorių bei kuris procesas yra oksidacija, o kuris – redukcija.
- C + CO2 → CO;
- Cu + HNO3 → Cu(NO3)2 + NO2 + H2O.
- Išlyginkite lygtį. Išlygintąją lygtį perrašykite sutrumpintąja jonine lygtimi. Nurodykite, kuris elementas yra reduktorius, o kuris – oksidatorius, kuris jonas ar molekulė yra reduktorius, o kuris – oksidatorius.
NH3 + KMnO4 + KOH → KNO3 + K2MnO4 + H2O. - Vanadis yra 5-osios, o azotas 15-osios grupės elementai. Kokio didžiausio oksidacijos laipsnio gali būti šie elementai? Parašykite natrio nitrato ir natrio vanadato chemines formules.
