Halogènas, metãlų įtampų (aktyvùmo) eilė, oksidãtorius, redùktorius, pavadãvimo reãkcija.
Halogenų pavadavimo reakcijos
Pavadãvimo reãkcija – tai vieninės ir sudėtinės medžiagos reakcija, kuriai vykstant susidaro nauja vieninė ir nauja sudėtinė medžiaga.
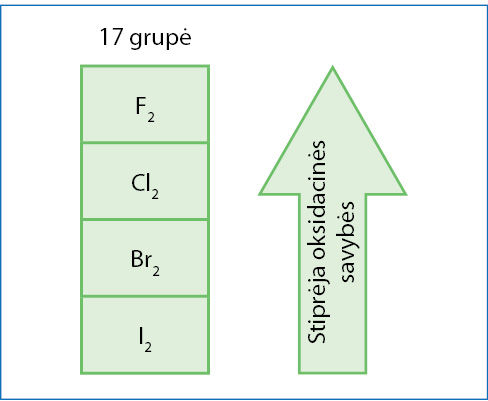
17-osios grupės elementų vieninės medžiagos yra stiprūs oksidatoriai. Jų oksidacinės savybės grupėje stiprėja iš apačios į viršų (7.2.1 pav.). Stipriausias oksidatorius yra fluoras F2. Jis gali išstumti (pavaduoti) bet kurį kitą halogeną ir net deguonį:
F2(d) + 2NaCl(k) → 2NaF(k) + Cl2(d);
(7.2.1)
2F2(d) + 2H2O(s) → 4HF(aq) + O2(d).
(7.2.2)
Fluoro reakcijos su halogenidų vandeniniais tirpalais galimos, tačiau vienu metu vyksta reakcija ne tik su halogenidu, bet ir su vandeniu, susidaro produktų mišiniai.
Chloras Cl2 su vandeniu reaguoja lėtai ir tik apšviestas. Tamsoje 100 g 20 °C temperatūros vandens gali ištirpti apie 0,7 g chloro, susidaro vadinamasis chloro vanduo Cl2(aq). Šviesoje lėtai vyksta tokios reakcijos:
Cl2(aq) + H2O(s) → HCl(aq) + HClO(aq);
(7.2.3)
2HClO(aq) → 2HCl(aq) + O2(d).
(7.2.4)
Kiti halogenai su vandeniu reaguoja nežymiai, reakcijos produktų išeiga yra nykstamai maža.
Chloras gali išstumti bromą ir jodą, o bromas – tik jodą. Šioms reakcijoms naudojami druskų vandeniniai tirpalai:
Cl2(d) + 2NaBr(aq) → 2NaCl(aq) + Br2(s);
(7.2.5)
Cl2(d) + 2NaI(aq) → 2NaCl(aq) + I2(k);
(7.2.6)
Br2(s) + 2NaI(aq) → 2NaBr(aq) + I2(k).
(7.2.7)
Metalų aktyvumas
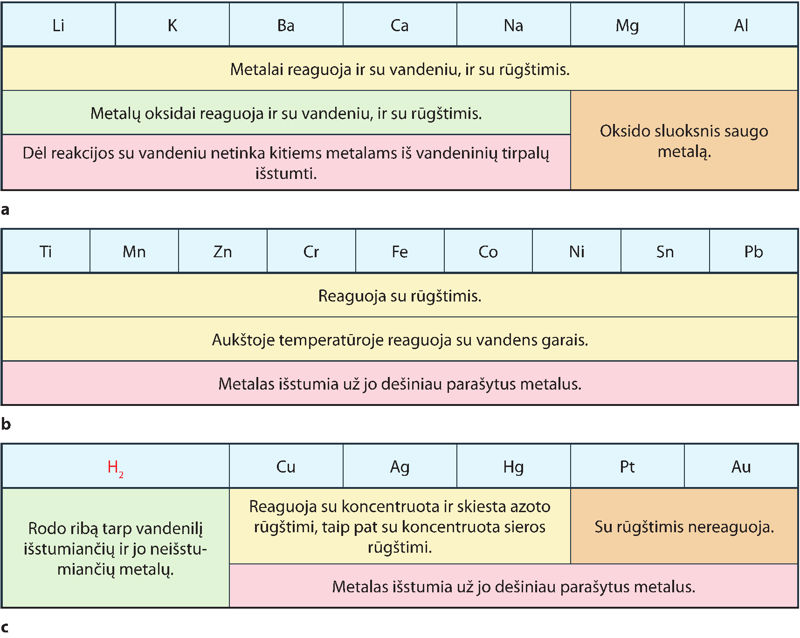
Apie metalų gebėjimą dalyvauti pavadavimo reakcijose sprendžiama iš vadinamosios metãlų įtampų eilės (7.2.2 pav., a). Patys aktyviausi yra šarminiai, šarminių žemių metalai ir aliuminis. Tai stipriausi reduktoriai. Jų teigiamieji jonai yra silpni oksidatoriai. Tai reiškia, kad metalai lengvai praranda elektronus, o jų jonus redukuoti sunku. Pavyzdžiui, natris audringai reaguoja su vandeniu, praranda elektronus ir įgyja oksidacijos laipsnį +1:
(7.2.8)
Išgauti natrį iš junginių pavyksta tik nesant vandens, pavyzdžiui, elektrolizuojant išlydytą junginį (išsamiau apie šią reakciją – kiek vėliau):
(7.2.9)
Magnis ir aliuminis šiek tiek skiriasi nuo likusiųjų šios dalies (7.2.2 pav., a) metalų. Pavyzdžiui, dirbiniai iš aliuminio tinka naudoti kasdien, juos saugo paviršiuje susidarantis gana inertiško aliuminio oksido sluoksnis. Magnio paviršių taip pat padengia oksido sluoksnis, tiesa, jis nėra toks inertiškas, kaip aliuminio oksido sluoksnis. Su vandeniu magnio reakcija labai lėta, mat susidarantis netirpus magnio hidroksidas Mg(OH)2 trukdo vandens molekulėms pasiekti metalą.
Įtampų eilės pabaigoje (7.2.2 pav., c) yra mažiausio aktyvumo metalai. Tai silpniausi reduktoriai, o jų jonai pasižymi oksidacinėmis savybėmis, juos gana lengva redukuoti:
(7.2.10)
Iš mažo aktyvumo metalų – vario, sidabro, aukso – ir jų lydinių nuo seniausių laikų gaminami papuošalai, monetos (7.2.3 pav.).

Elektrocheminės metalų įtampų eilės vidurinėje dalyje (7.2.2 pav., b) yra vidutinio aktyvumo metalai. Jie reaguoja su rūgštimis, išstumia mažiau aktyvius metalus iš jų junginių, pavyzdžiui:
Zn(k) + H2SO4(aq) → ZnSO4(aq) + H2(d);
(7.2.11)
Zn(k) + CuSO4(aq) → ZnSO4(aq) + Cu(k).
(7.2.12)
1 pavyzdys
Kokia reakcija (arba reakcijos) vyksta į švino etanoato Pb(CH3COO)2 ir cinko sulfato ZnSO4 tirpalų mišinį panardinus geležinę vinį? Parašykite bendrąsias ir sutrumpintąsias jonines lygtis. Nurodykite oksidatorių ir reduktorių.
Sprendimas
Metalų įtampų eilėje (7.2.2 pav.) matome, kad geležis yra tarp cinko ir švino. Geležis gali redukuoti švino jonus (išstumti šviną), bet negali redukuoti cinko jonų. Vyks tik viena reakcija:
Fe(k) + Pb(CH3COO)2(aq) → Pb(k) + Fe(CH3COO)2(aq).
Sutrumpintoji joninė lygtis:
Fe(k) + Pb2+(aq) → Pb(k) + Fe2+(aq).
Atsakymas: oksidatorius Pb2+ jonai, reduktorius – Fe atomai.
Masės pokytis vykstant pavadavimo reakcijai
2 pavyzdys
Į švino(II) etanoato vandeninį tirpalą panardintos 20,00 g geležinės plokštelės paviršių padengė švino sluoksnis. Plokštelės masė tapo 27,56 g. Apskaičiuokite:
- plokštelės paviršiuje nusėdusio švino ir ištirpusios geležies masę;
- tirpalo masės pokytį.
Sprendimas
- Spręsdami 1 pavyzdžio užduotį sudarėme sutrumpintąją joninę lygtį:
Fe(k) + Pb2+(aq) | → Pb(k) + Fe2+(aq); | |
–x mol | +x mol | metalų kiekis moliais; |
–55,85x g | +207,20x g | metalų masė gramais. |
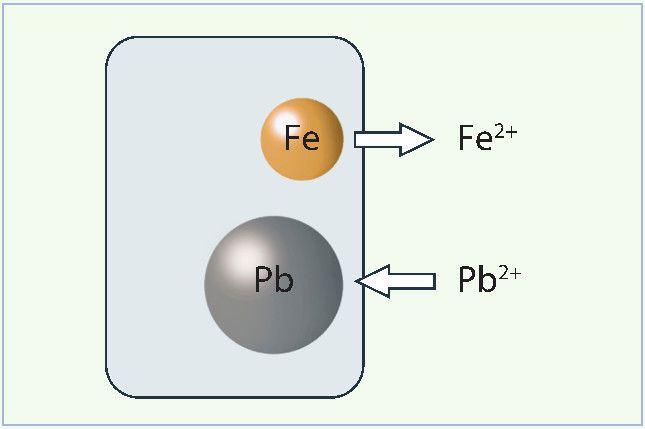
Vykstant reakcijai x mol geležies atomų virsta Fe2+ jonais ir pasklinda tirpale (7.2.4 pav.). Dėl šio proceso metalinės plokštelės masė sumažėja, todėl rašome minuso ženklą; masės pokytis yra –55,85x g. Tirpale buvę Pb2+ jonai redukuojami, jie nusėda metalinės plokštelės paviršiuje ir taip padidina jos masę (+207,20x g).
Plokštelės masės pokytis:
27,56 g – 20,00 g = 207,20x g – 55,85x g,
7,56 = 151,35x;
x = 0,04995 mol.
m(Pb) = 207,20x = 207,20 g/mol · 0,04995 mol = 10,35 g;
m(Fe) = 55,85x = 55,85 g/mol · 0,04995 mol = 2,79 g.
- Kiek padidėjo metalinės plokštelės masė, tiek pat sumažėjo tirpalo masė. Tad tirpalo masė pasibaigus reakcijai yra 7,56 g mažesnė nei prieš bandymą.
Komentaras. Metalinės plokštelės masė žinoma keturiais reikšminiais skaitmenimis, o masės pokytis (7,56 g) tik trimis. Todėl medžiagos kiekis 0,04995 mol irgi žinomas tik trimis reikšminiais skaitmenimis. Skaitmuo 5 čia yra papildomas, paliktas tik tam, kad nesikauptų apvalinimo paklaidos.
Atsakymas:
- 10,35 g švino, 2,79 g geležies;
- tirpalo masė sumažėjo 7,56 g.
Klausimai ir užduotys
- Bromas naudojamas vaistų, pesticidų gamybai. Jūros vandenyje bromido jonų koncentracija yra apie 65 mg/kg. Garinant jūros vandenį gaunamas sūrimas, kurį paveikus chloro dujomis išsiskiria bromas. Įmonė pagamino 1,0 toną bromo. Apskaičiuokite įmonės sunaudotą:
- chloro dujų tūrį (standartinėmis sąlygomis);
- jūros vandens masę.
- Du vienodi magnio gabaliukai vienu metu įdėti į vienodo tūrio 1,0 mol/l koncentracijos druskos rūgšties HCl(aq) ir etano rūgšties CH3COOH(aq) tirpalus.
- Parašykite vienu ir kitu atveju vykstančios reakcijos sutrumpintąją joninę lygtį.
- Nurodykite, kuriame šių tirpalų magnis sureaguos per trumpesnį laiką, ir paaiškinkite, kodėl.
- Metalų oksidus galima redukuoti kitu, aktyvesniu metalu, pavyzdžiui, geležies(III) oksidą redukuoti aliuminiu. Oksidą sumaišius su aliuminio milteliais ir pakaitinus, prasideda egzoterminė reakcija. Mišinys įkaista tiek, kad susidariusi geležis išsilydo. Redukuojant 12,8 g geležies(III) oksido, išsiskiria 68,2 kJ šilumos.
- Kodėl kai kurios reakcijos prasideda tik pakaitinus, o kai reakcija prasideda, kaitinti nebereikia?
- Sudarykite geležies(III) oksido redukcijos aliuminiu termocheminę lygtį.
- Apskaičiuokite aliuminio masę, kuri sunaudojama 0,28 kg geležies gauti.
- Į sidabro nitrato tirpalą panardintos švininės plokštelės paviršių padengė sidabro sluoksnis, o plokštelės masė padidėjo 0,222 g.
- Kokiu molių santykiu reaguoja švino atomai ir sidabro jonai?
- Kiek gramų sidabro nusėdo ant plokštelės paviršiaus?
- Kiek pakito tirpalo masė?
- Į 0,12 kg tirpalo, kuriame švino(II) nitrato procentinė koncentracija 5,0 %, įbėrus cinko granulių perteklių, įvyko pavadavimo reakcija. Apskaičiuokite cinko nitrato procentinę koncentraciją tirpale pasibaigus reakcijai, jei visi švino jonai buvo redukuoti.
