Mainų reãkcija, oksidãcijos-redùkcijos reãkcija, oksidãcijos láipsnis, stiprióji rūgštis, pasỹvinimas.
Praktikoje dažniausiai naudojamos rūgštys yra druskos, azoto ir sieros (7.2 lentelė). Tai stipriosios rūgštys, t. y. tokios, kurios vandeniniuose tirpaluose visiškai jonizuojasi (suskyla į H+ ir rūgšties liekanos jonus). Joms būdingos mainų ir oksidacijos-redukcijos reakcijos.
7.2 lentelė
HCl | H2SO4 | HNO3 |
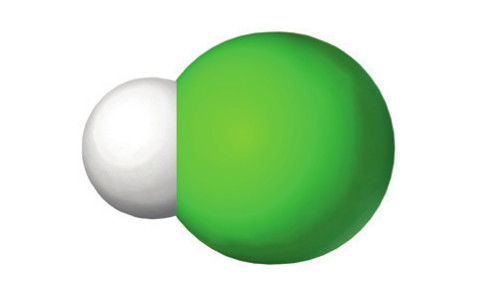 | 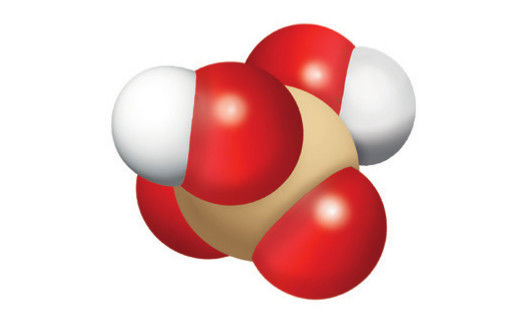 | 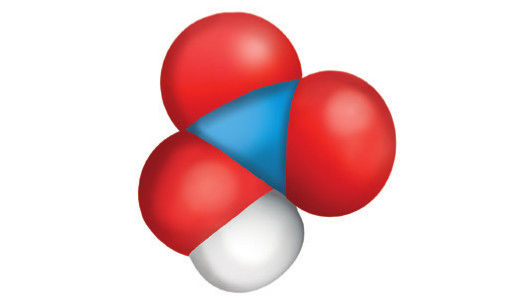 |
Druskos, arba vandenilio chlorido, rūgštis | Sieros, arba sulfato, rūgštis | Azoto, arba nitrato, rūgštis |
Natrio chloridas NaCl | Geležies(III) sulfatas Fe2(SO4)3, kalio-vandenilio sulfatas, arba kalio hidrosulfatas KHSO4 | Chromo(III) nitratas Cr(NO3)3 |
Mainų reakcijos
Vykstant mainų reakcijoms nė vieno iš elementų oksidacijos laipsnis nekinta. Visos trys nagrinėjamos rūgštys reaguoja su:
- baziniais oksidais:
CaO(k) + 2HCl(aq) → CaCl2(aq) + H2O(s);
(7.3.1)
- amfoteriniais oksidais:
ZnO(k) + 2HNO3(aq) → Zn(NO3)2(aq) + H2O(s);
(7.3.2)
- bazėmis (hidroksidais, amoniaku):
KOH(aq) + HNO3(aq) → KNO3(aq) + H2O(s);
(7.3.3a)
NH3(aq) + H2SO4(aq) → NH4HSO4(aq);
(7.3.3b)
2NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq);
(7.3.3c)
- druskomis, jeigu tenkinama kuri nors iš mainų reakcijos sąlygų (jei reikia, pasikartokite 4.7 temą):
Ag3PO4(k) + 3HNO3(aq) → 3AgNO3(aq) + H3PO4(aq).
(7.3.4)
Oksidacijos-redukcijos reakcijos
Drùskos rūgštis reaguoja tik su tais metalais, kurie įtampų eilėje yra iki vandenilio. Vyksta pavadavimo reakcija. Oksidatorius yra vandenilio jonas H+, o reduktorius – metalo atomas:
Fe(k) + 2HCl(aq) → FeCl2(aq) + H2(d).
(7.3.5)
Azoto rūgšties liekana yra labai stiprus oksidatorius, todėl šiai rūgščiai būdingos kelios išskirtinės savybės (7.3.1 pav.):
- azoto rūgščiai sąveikaujant su metalais, keičiasi ne vandenilio, o azoto oksidacijos laipsnis;
- redukuojantis nitrato jonui, dažniausiai susidaro NO2 arba NO (kartais gali susidaryti ir N2O, N2,
NH 4 + - kuris nitrato redukcijos produktas susidarys, priklauso nuo metalo aktyvumo ir rūgšties koncentracijos;
- azoto rūgščiai sąveikaujant su metalais, nesusidaro vandenilio dujų;
- azoto rūgštis reaguoja su dalimi metalų, kurie įtampų eilėje yra už vandenilio (Cu, Ag, Hg);
- azoto rūgštis nereaguoja su tauriaisiais metalais (Pt, Au);
- kai kuriuos metalus (Al, Fe) koncentruota azoto rūgštis pasyvina.
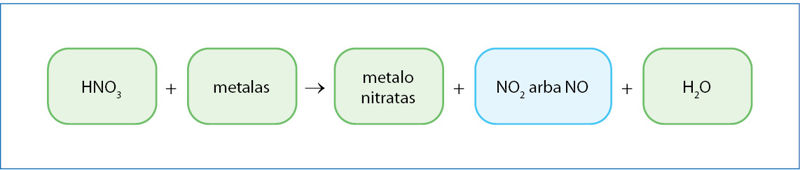
Kas būtent susidarys redukuojantis nitrato jonui, priklauso nuo temperatūros, metalo aktyvumo ir rūgšties koncentracijos. Jei azoto rūgštis reaguoja su vidutinio ir mažo aktyvumo metalais, dažniausiai susidaro:
- NO2, jei rūgštis yra koncentruota (30 %, arba 6 mol/l, ir didesnės koncentracijos);
- NO, jei rūgštis yra praskiesta.
Pavyzdžiui:
Hg(s) + 4HNO3(koncentruota) → Hg(NO3)2(aq) + 2NO2(d) + 2H2O(s);
(7.3.6)
3Hg(s) + 8HNO3(praskiesta) → 3Hg(NO3)2(aq) + 2NO(d) + 4H2O(s).
(7.3.7)
Dalį metalų – Al, Fe, Cr, Ni – koncentruota azoto rūgštis pasyvina. Paveikus metalą rūgštimi, reakcija prasideda, tačiau netrukus sustoja, nes susidaro ne druska, o plona, tanki ir nereaktyvi metalo oksido plėvelė. Pasyvintas metalas nereaguoja su rūgštimis ar kitomis medžiagomis, su kuriomis paprastai reaguoja. Metalus geriausiai pasyvina žemos temperatūros ir didelės koncentracijos azoto rūgštis. Su karšta rūgštimi šie metalai reaguoja.
Sieros rūgštis su metalais reaguoja dvejopai:
- praskiesta – lygiai taip pat, kaip druskos rūgštis;
- koncentruota (daugiau kaip 92 %) (7.3.2 pav.) – panašiai kaip azoto rūgštis, t. y.:
- keičiasi ne vandenilio, o sieros oksidacijos laipsnis;
- redukuojantis sulfato jonui, susidaro SO2 (kartais S arba H2S);
- nesusidaro vandenilio dujų;
- reaguoja su dalimi metalų, kurie įtampų eilėje yra už vandenilio (Cu, Ag, Hg);
- nereaguoja su tauriaisiais metalais (Pt, Au);
- kai kuriuos metalus koncentruota sieros rūgštis pasyvina, tačiau šios rūgšties pasyvinamasis poveikis gerokai silpnesnis už azoto rūgšties.
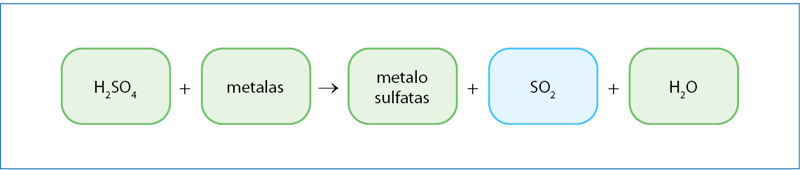
Sieros rūgšties sąveikos su metalais pavyzdžiai:
Zn(k) + H2SO4(praskiesta) → ZnSO4(aq) + H2(d);
(7.3.8)
Cu(k) + H2SO4(praskiesta) → nereaguoja;
(7.3.9)
Cu(k) + 2H2SO4(koncentruota) → CuSO4(aq) + SO2(d) + 2H2O(s).
(7.3.10)
Klausimai ir užduotys
- Išnagrinėkite 7.2 lentelę ir nurodykite, su kuriuo elementu visose deguoninėse rūgštyse yra susijungęs vandenilio atomas. Remdamiesi pastebėtu dėsningumu, sudarykite fosforo rūgšties H3PO4 molekulės modelį arba struktūrinę formulę.
- Parašykite ir išlyginkite bendrąsias sidabro reakcijos su praskiesta ir koncentruota azoto rūgštimi lygtis. Išlyginę parašykite sutrumpintąsias jonines lygtis.
- Cinko, geležies, vario ir sidabro miltelių mišinys paveiktas druskos rūgšties tirpalu. Kurie metalai reaguos su druskos rūgšties tirpalu? Parašykite bendrąsias ir sutrumpintąsias jonines reakcijų lygtis, nurodykite, kas oksiduojasi, o kas redukuojasi.
- 7,2 g aliuminio ir vario drožlių mišinio paveikus druskos rūgšties tirpalo pertekliumi, išsiskyrė 2,72 litro dujų. Tūris matuotas esant standartinėms sąlygoms. Apskaičiuokite vario masės dalį (procentais) pradiniame metalų mišinyje.
- Trijose vienodos masės stiklinėse buvo po 200 g 5,0 % druskos rūgšties tirpalo. Į vieną stiklinę įmesta 1,0 g aliuminio, į kitą 1,0 g cinko, į trečią 1,0 g magnio. Kurios stiklinės su tirpalu masė pasibaigus reakcijai bus: a) didžiausia; b) mažiausia? Atsakymą pagrįskite.
