Jòninis kristãlas, elektrolizė, katijònas, anijònas, katòdas, anòdas.
Prisiminkite kietosios būsenos joninių medžiagų sandarą (žr. 3.1 temą). Jonai kristale išsidėstę labai glaudžiai ir negali laisvai judėti, todėl kietosios būsenos joninės medžiagos nelaidžios elektros srovei. Išlydžius tokią medžiagą, kristalas suyra, jonai pradeda judėti, todėl išlydytos joninės medžiagos laidžios elektros srovei. Jomis leidžiant nuolatinę elektros srovę, vyksta elektrolizės reakcija.
Elektrolizė – tai oksidacijos-redukcijos reakcija, vykstanti jonų turinčiu tirpalu ar lydalu leidžiant nuolatinę elektros srovę.
Išlydyto natrio chlorido elektrolizė
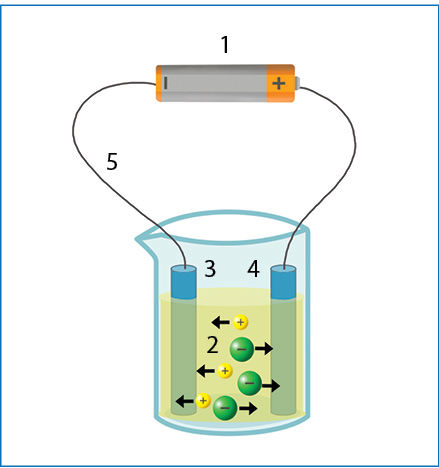
Elektrolizei vykti reikalingos priemonės parodytos 7.4.1 paveiksle. Elektros srovę leidžiant išlydytu natrio chloridu, teigiamieji jonai (katijònai) juda neigiamojo elektrodo (katòdo) link, o neigiamieji (anijònai) – teigiamojo elektrodo (anòdo) link. Srovės šaltinis į neigiamąjį elektrodą siunčia elektronus. Kai teigiamasis jonas prisiliečia prie neigiamojo elektrodo, iš šio elektrodo elektronas peršoka į joną ir jį redukuoja:
Na+(s) + 1e– → Na(s).
(7.4.1)
Kai chlorido jonas patenka prie teigiamojo elektrodo, šis atima elektroną ir oksiduoja chlorido joną:
Cl–(s) – 1e– → Cl;
(7.4.2)
Cl + Cl → Cl2(d).
(7.4.3)
Sudėję dalines lygtis, gauname:
(7.4.4 )
Prie katodo vyksta redukcija, o prie anodo – oksidacija (prisiminti padės pastebėjimas, kad žodžiai „katodas“ ir „redukcija“ prasideda priebalse, o „anodas“ ir „oksidacija“ – balse).
Laboratorijoje atlikti bandymus su išlydytomis joninėmis medžiagomis keblu dėl aukštos temperatūros. Pramonėje tokia elektrolizė pasitelkiama didžiuliais kiekiais gaminant natrį ir chlorą. Daug chloro sunaudojama dezinfekuojant vandenį, balinant popierių, gaminant organinius tirpiklius, plastikus. Natris reikalingas išgaunant kitus chemiškai aktyvius metalus, gaminant natrio hidroksidą. Atominėse elektrinėse skystas natris naudojamas reaktoriams aušinti.
Pramoniniai išlydyto natrio chlorido elektrolizeriai sukonstruoti taip, kad reakcijos produktai (skystas natris ir dujinis dichloras) nesusimaišytų ir negalėtų reaguoti tarpusavyje.
Natrio chlorido tirpalo elektrolizė
Kita jonams judėti tinkama terpė – vandeninis tirpalas. Tirpinamas natrio chloridas disocijuoja:
(7.4.5)
Elektrolizei tinka 7.4.1 paveiksle parodytos priemonės. Praktiškai atlikti tokį procesą gana paprasta, nes elektrolizė vyksta kambario temperatūroje. Kaip ir išlydytoje medžiagoje, vandeniniame natrio chlorido tirpale teigiamieji jonai juda neigiamojo elektrodo link, o neigiamieji – teigiamojo link. Tačiau yra vienas esminis skirtumas. Be natrio ir chlorido jonų, dar yra polinių vandens molekulių (7.4.2 pav.), kurios irgi gali dalyvauti elektrolizės procese. Natris ir kiti aktyvieji metalai (7.2.2 pav., a, iki aliuminio imtinai) reaguoja su vandeniu, tad jų jonų vandeniniame tirpale redukuoti neįmanoma. Vietoj metalo redukuojamas vanduo (elektronai atitenka ne natrio jonui, o prie elektrodo esančioms vandens molekulėms):
2H2O(s) + 2e– → 2OH–(aq) + H2(d).
(7.4.6)
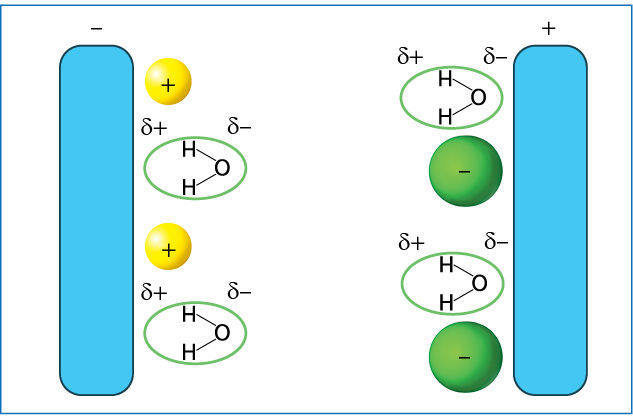
Prie teigiamojo elektrodo irgi yra dvejopų dalelių – chlorido jonų ir neigiamuoju galu į elektrodą pasisukusių vandens molekulių. Chloro elektrinis neigiamumas mažesnis už deguonies, todėl elektronus atimti iš chlorido lengviau. Čia, kaip ir išlydytoje medžiagoje, vyksta chlorido jonų oksidacija, susidaro dichloro molekulės:
2Cl–(aq) – 2e– → Cl2(d).
(7.4.7)
Suminė joninė elektrolizės lygtis:
(7.4.8)
arba bendroji:
(7.4.9)
Pramonėje tokia elektrolizė taikoma gaminant tris dideliais kiekiais naudojamas medžiagas – vandenilio ir chloro dujas bei natrio hidroksidą.
Klausimai ir užduotys
- Elektrolizuojamas išlydytas: a) kalio chloridas; b) natrio bromidas. Parašykite dalines lygtis, kuriomis būtų parodyta, kas vyksta prie teigiamojo, ir kas – prie neigiamojo elektrodo, taip pat sumines elektrolizės lygtis.
- Elektrolizuojamas vandenyje ištirpintas: a) kalio chloridas; b) natrio bromidas. Parašykite dalines lygtis, kuriomis būtų parodyta, kas vyksta prie teigiamojo ir kas – prie neigiamojo elektrodo, taip pat sumines elektrolizės lygtis.
- Tvirti mažo tankio magnio lydiniai puikiai tinka aviacijos reikmėms. Magnis išgaunamas dviem būdais – magnio oksidą redukuojant siliciu arba elektrolizuojant išlydytą magnio chloridą.
- Parašykite išlydyto magnio chlorido elektrolizės dalines ir suminę lygtį.
- Nurodykite, kokių produktų susidarytų elektrolizuojant magnio chlorido vandeninį tirpalą.
- Parašykite magnio oksido redukcijos siliciu bendrąją lygtį.
- Paaiškinkite, kodėl magnis neišgaunamas elektrolizuojant vandeninį magnio chlorido tirpalą.
- Negyvosios jūros vandenyje yra didelė natrio bromido koncentracija. Pasiūlykite du bromo Br2(s) gavimo iš natrio bromido tirpalo būdus. Kiekvienu atveju parašykite dalines ir bendrąją reakcijos lygtį.
- Elektrolizuojant 0,20 kg vandeninio tirpalo, kuriame natrio chlorido masės dalis lygi 15 %, išsiskyrė 0,10 mol chloro dujų. Apskaičiuokite:
- išsiskyrusių vandenilio dujų tūrį standartinėmis sąlygomis;
- natrio hidroksido masės dalį (procentais) tirpale;
- likusio natrio chlorido masės dalį (procentais) tirpale.
- Aliuminis gaunamas elektrolizuojant išlydytas medžiagas, o ne tirpalą. Paaiškinkite, kodėl.
