Elektrolizė: apibendrinimas
Elektrolizė – tai oksidacijos-redukcijos reakcija, kuri vyksta nuolatinę elektros srovę leidžiant jonų turinčiu tirpalu arba lydalu (išlydyta medžiaga). Elektrolizės procesų įvairovė apibendrinta 7.6.1 ir 7.6.2 lentelėse. Nagrinėdami elektrolizės reakciją, išsirenkame tinkamą redukcijos proceso dalinę lygtį iš vienos lentelės ir oksidacijos proceso dalinę lygtį iš kitos lentelės. Sudėję dalines lygtis (taip, kaip įprasta lyginant oksidacijos-redukcijos lygtis), gauname procesą aprašančią lygtį.
7.6.1 lentelė. Prie neigiamojo elektrodo (katodo) vykstantys elektrolizės procesai
Tirpale esantys teigiamieji jonai (pagal metalų įtampų eilę) | Vykstantis procesas |
Aktyviųjų metalų (nuo ličio iki aliuminio imtinai) | Vyksta vandens redukcija, skiriasi vandenilio dujos, tirpalas prie elektrodo darosi bazinis. 2H2O(s) + 2e– → H2(d) + 2OH–(aq). |
Vidutinio aktyvumo metalų (už aliuminio, iki vandenilio) | Vyksta kelios reakcijos vienu metu. Susidaro ir metalas, ir vandenilio dujos, pavyzdžiui: Zn2+(aq) + 2e– → Zn(k); |
H+ | 2H+(aq) + 2e– → H2(d). |
Mažo aktyvumo metalų | Susidaro metalas, pavyzdžiui: Cu2+(aq) + 2e– → Cu(k). |
7.6.2 lentelė. Prie teigiamojo elektrodo (anodo) vykstantys elektrolizės procesai
Anodo tipas | Tirpale esantys neigiamieji jonai | Vykstantis procesas |
Inertinis anodas (pagamintas iš grafito, platinos, aukso) | Bedeguonių rūgščių liekanos (išskyrus F–) | Oksiduojamas bedeguonis anijonas, išsiskiria atitinkamas nemetalas, pavyzdžiui: |
Deguoninių rūgščių liekanos, OH– ir F– | Oksiduojama vandens molekulė, skiriasi deguonies dujos. Tirpalas prie elektrodo rūgštėja. | |
Tirpusis anodas (pagamintas iš sidabro, vario) | Nesvarbu, kokių anijonų yra tirpale | Oksiduojamas metalas, iš kurio pagamintas anodas. Metalinė plokštelė plonėja, metalo atomai virsta jonais ir pasklinda tirpale, pavyzdžiui: |
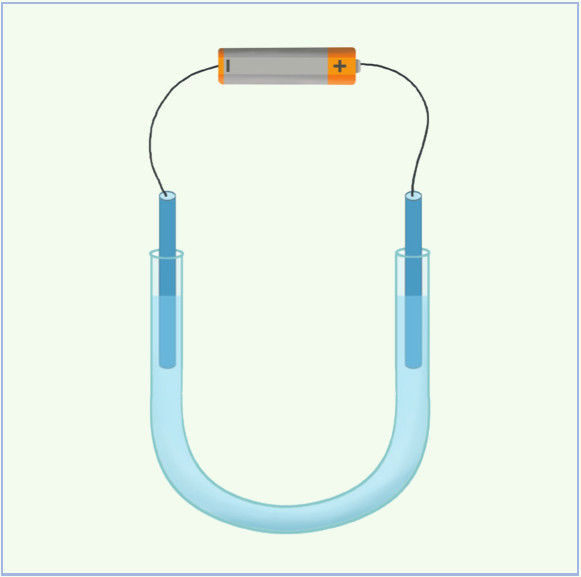
1 pavyzdys
Į U formos vamzdelį įpilta natrio sulfato vandeninio tirpalo, įmerkti grafitiniai elektrodai prijungti prie baterijos (7.6.1 pav.). Išnagrinėkite:
- kaip keičiasi tirpalo terpė prie vieno ir kito elektrodo;
- kokia suminė elektrolizės reakcija vyksta.
Sprendimas
Tirpale yra aktyvaus metalo – natrio jonų. Vadinasi, vyks procesas, nurodytas 7.6.1 lentelės pirmojoje eilutėje. Anijonai yra deguoninės rūgšties, o anodas iš grafito, tad vyks 7.6.2 lentelės antrojoje eilutėje nurodytas procesas.
prie (–) elektrodo:
2H2O(s) + 2e– → H2(d) + 2OH–(aq) |×2;
prie (+) elektrodo:
2H2O(s) – 4e– → O2(d) + 4H+(aq) |×1.
- Prie katodo tirpalas darosi rūgštinis, prie anodo – bazinis.
- Tirpale vyksta tik vandens elektrolizė. Tirpalui maišantis OH– jonai susijungia su H+ jonais, sudarydami vandens molekules. Galutinė bendroji elektrolizės lygtis:
Elektrolizės naudojimas
Nagrinėdami ankstesnius pavyzdžius, jau susidūrėme su elektrolizės naudojimu.
- Metalų gavyba. Tinka įvairiems metalams, bet dažniausiai naudojama išgaunant pačius aktyviausius metalus (prisiminkite išlydyto natrio chlorido elektrolizę).
- Įvairių kitų cheminių medžiagų gavyba. Prisiminkite pavyzdžius, kai elektrolizuojant susidaro H2, Cl2, O2, NaOH.
- Metalų dangos gamyba. Pavyzdžiui, plieninės detalės vykdant elektrolizę dengiamos chromo, nikelio, sidabro sluoksniu. Tai daroma siekiant pagerinti gaminio estetinį vaizdą arba apsaugoti metalą nuo korozijos.
- Metalų gryninimas. Priemaišų turintis metalo luitas naudojamas kaip tirpusis anodas. Parenkamos tokios elektrolizės sąlygos, kad prie katodo redukuotųsi tik šio metalo jonai, o priemaišos liktų tirpale arba sudarytų netirpius junginius.
Klausimai ir užduotys
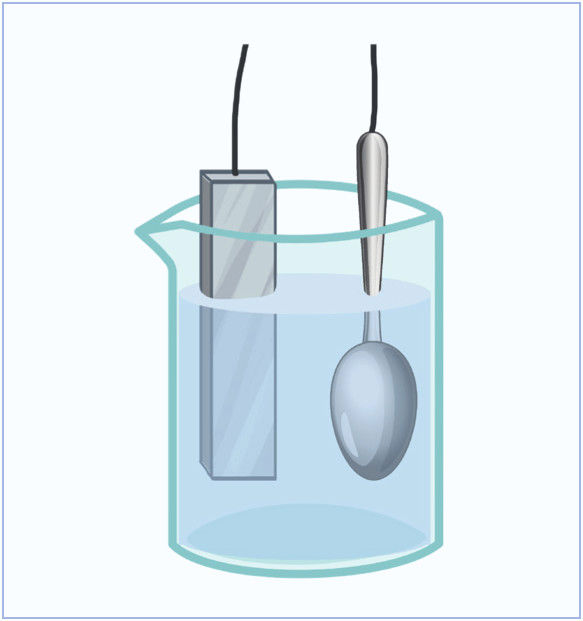
- Sidabriniai stalo įrankiai vertinami dėl išvaizdos ir antibakterinių savybių. Deja, jie yra brangūs. Pigesni yra sidabruoti įrankiai. Pavyzdžiui, plieninis šaukštas elektrolizuojant padengiamas plonu sidabro sluoksniu (7.6.2 pav.).
- Prie kurio – teigiamojo ar neigiamojo – elektros srovės šaltinio poliaus reikia prijungti sidabruojamą šaukštą?
- Sidabro dangos kokybė priklauso nuo tirpalo sudėties. Geriausia, jei tirpalo sudėtis vykstant elektrolizei nesikeičia. Iš ko turi būti pagamintas kitas elektrodas, kad tirpalo sudėtis nekistų?
- Kokybiškai metalų dangai gauti netinka tirpalai, kuriuose tirpinys yra viena metalo jonų turinti druska, pavyzdžiui, sidabro nitratas. Elektrolizuojant tokius tirpalus metalo danga būna silpnai prikibusi prie pagrindo, dažnai susidaro įvairių smulkių, korėtų ataugų. Pramonėje naudojami įvairių priedų turintys druskų tirpalai. Vienas iš daugelio sidabravimo tirpalų priedų yra kalio cianidas KCN. Pasidomėkite, kokių aplinkos apsaugos ar darbo saugos problemų kyla dėl šios medžiagos naudojimo.
- Į U formos vamzdelį (7.6.1 pav.) įpilta kalio perchlorato KClO4 tirpalo, įlašinta lakmuso tirpalo ir vykdyta elektrolizė. Nurodykite, kaip pakis lakmuso spalva prie neigiamojo ir kaip – prie teigiamojo elektrodo. Paaiškinkite, kodėl pasikeis būtent taip.
- Nurodykite, kokie procesai vyksta elektrolizuojant kalio fluorido KF vandeninį tirpalą, užrašykite šiuos procesus dalinėmis lygtimis.
