Cheminių formulių užuomazgos
Viso pasaulio chemikai naudojasi viena suprantama kalba. Tai – formulių kalba. Dar alchemijos laikais įvairiais sutartiniais ženklais, piešiniais buvo stengiamasi užrašyti medžiagų formules (3.5.1 pav.), tačiau vienos, visiems patogios sistemos nebuvo.

Tik XIX a. pradžioje pradėjus naudotis švedų mokslininko Jenso Jakobo Berselijaus (Jöns Jacob Berzelius, 1779–1848) pasiūlytais cheminių elementų žymėjimais, atsirado būdas vienodai ir visiems suprantamai užrašyti medžiagų formules. Jau seniai žinoma, kad medžiagų elementai jungiasi vieni su kitais tam tikrais ryšiais. Anglų chemikas Džonas Daltonas (John Dalton, 1766–1844) (3.5.2 pav.) pastebėjo, kad šie ryšiai priklauso nuo atskirų elementus sudarančių dalelių – atomų – savybių. Žinant šias savybes daug lengviau sudaryti chemines formules. Šis jo atradimas padėjo tolesnio atomų ir molekulių tyrinėjimo pagrindus.
Tai įdomu!
Džonas Daltonas – garsus anglų chemikas, fizikas ir meteorologas. Dėl pinigų stygiaus jam teko dirbti nuo 10 metų. Vėliau jis vertėsi privačiomis pamokomis, tapo matematikos ir gamtos filosofijos mokytoju. Dž. Daltonas atliko daugybę eksperimentų ne tik chemijos ir fizikos, bet ir meteorologijos srityse. Jo paskelbtos publikacijos tapo visuotinai žinomos ir įvertintos. Dar ir dabar atominiai masės vienetai kartais vadinami daltonais. Jis pirmasis pasaulyje paaiškino spalvų neskyrimą – šis regėjimo sutrikimas vėliau pavadintas daltonizmu.

Elementų savybių svarba sudarant chemines formules
Junginių cheminėmis formulėmis rodoma, iš kokių elementų yra sudaryti junginiai ir koks yra tų elementų santykis.
Pirmiausia prisiminkime cheminių elementų savybes, kurios bus svarbios sudarant chemines formules. Jau žinome, kad elementų savybės priklauso nuo atomų išorinio elektronų sluoksnio. Kaip pavyzdį panagrinėkime periodinės lentelės antrojo periodo elementus (3.5.3 pav.).

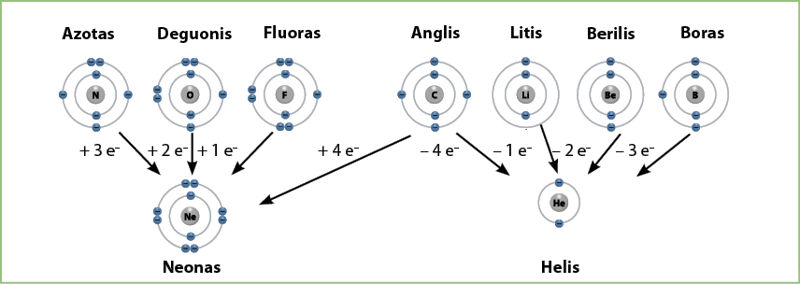
Jau minėjome, kad stabiliausias atomas arba jonas yra toks, kurio išorinis elektronų sluoksnis užpildytas. Tokį sluoksnį iš antrojo periodo elementų turi neonas. Tam, kad elektronų sluoksnis būtų užpildytas, tik vieno elektrono trūksta fluoro atomui, dviejų – deguonies atomui, trijų – azoto atomui. Be to, šie trys elementai yra nemetalai, jiems būdingas didelis elektrinis neigiamumas (žr. 3.1.1 lentelę). Anglis taip pat yra nemetalas, ji yra periodo viduryje: prisijungęs 4 elektronus, anglies atomas turėtų išorinį elektronų sluoksnį, panašų į neono, o atidavęs 4 elektronus – panašų į helio. Helio atomas turi tik vieną elektronų sluoksnį. Užpildytame helio atomo išoriniame elektronų sluoksnyje yra tik du elektronai.
Kiti trys antrojo periodo elementai: metalai litis, berilis ir nemetalas boras, labiau linkę atiduoti elektronus, o ne juos prisijungti. Atidavus elektronus šių elementų išorinis elektronų sluoksnis tampa panašus į helio, t. y. nebelieka antrojo elektronų sluoksnio, o pirmajame yra du elektronai (3.5.4 pav.).
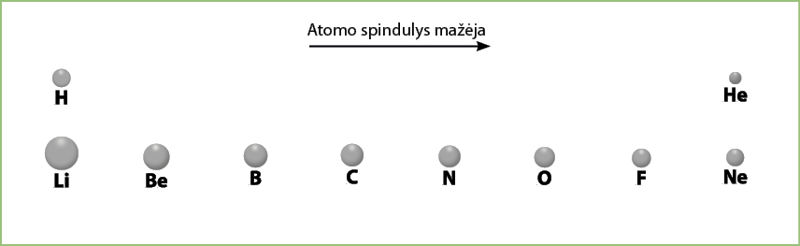
Yra dar viena ypatybė: perioduose atomo spindulys mažėja einant iš kairės į dešinę (3.5.5 pav.). Vadinasi, antrojo periodo elementas litis turės didesnį atomo spindulį negu to paties periodo paskutinis elementas neonas. Taip yra dėl to, kad, didėjant protonų skaičiui branduolyje, elektronai labiau traukiami branduolio, taigi yra ir sunkiau atiduodami.
Perioduose atomo spindulys mažėja iš kairės į dešinę.
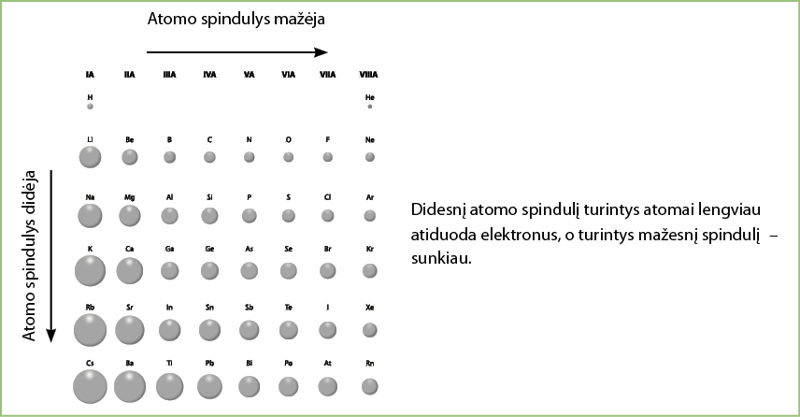
Prisiminkime – grupėse atomo spindulys didėja iš viršaus į apačią, t. y. kuo daugiau elektronų sluoksnių, tuo silpniau elektronai traukiami branduolio. Atomų spindulio nuoseklus kitimas grupėse ir perioduose pavaizduotas 3.5.6 paveiksle.
Aptartų cheminių elementų savybių mums prireiks sudarant cheminių junginių formules. Pasimokykime užrašyti paprasčiausių junginių, sudarytų tik iš dviejų cheminių elementų, formules.
Joninių junginių formulių sudarymas
Chèminė fòrmulė – tai elemento ar junginio sandaros išraiška, žymima simboliais ir indeksais.
Pirmiausia išsiaiškinkime, kaip sudaromos joninių junginių formulės. Jau žinote, kad joniniai junginiai susidaro susijungus metalui su nemetalu. Metalas atiduoda elektronus nemetalui, o nemetalas juos prisijungia.
Panagrinėkime, kaip IA grupės 2-ojo periodo metalas litis sudaro junginius su šio periodo nemetalais fluoru, deguonimi ir azotu. Ličiui susijungus su fluoru, deguonimi ir azotu, susidarys joniniai junginiai. Juose litis atiduos elektronus, o nemetalai (įskaitant anglį) juos prisijungs.
Atiduotų ir prijungtų elektronų skaičius junginyje turi sutapti. Tai vadinama elektròniniu balánsu.
Ličio atomo išoriniame elektronų sluoksnyje yra tik vienas elektronas. Taigi vienas ličio atomas jungsis su vienu fluoro atomu. Vienam deguonies atomui reikia dviejų ličio atomų elektronų – tai pažymime indeksu 2 prie ličio elemento simbolio. Vienam azoto atomui reikia net trijų ličio atomų, taigi ličio indeksas yra 3 (3.5.7 pav.).
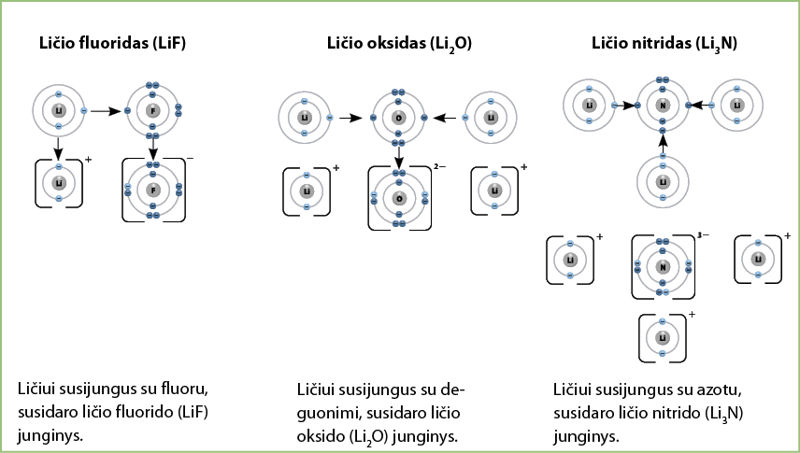
Norint užrašyti ličio junginių chemines formules, reikia parodyti, kiek teigiamųjų ličio jonų yra susijungę su susidariusiais neigiamaisiais jonais.
- Vienas ličio jonas susijungia su vienu fluoro jonu – cheminė formulė LiF.
- Du ličio jonai susijungia su vienu deguonies jonu – cheminė formulė Li2O.
- Trys ličio jonai susijungia su vienu azoto jonu – cheminė formulė Li3N.
Joninių junginių formulės yra empirinės – jomis rodoma, kokiu santykiu junginio elementai jungiasi vieni su kitais.
Kodėl? Jau minėjome, kad joniniai junginiai sudaro kristalus. Taigi joninių junginių formulės rodo jonų santykį kristale.
Pabandykime apibendrinti, kaip pažingsniui sudaryti cheminių junginių formules. Žinant aptartas cheminių elementų savybes, formules paprasta sudaryti naudojantis toliau pateiktu algoritmu (3.5.1 lentelė).
3.5.1 lentelė. Cheminių formulių sudarymo algoritmas
Algoritmo žingsniai | Pavyzdys | Pavyzdys |
1. Užrašome cheminio junginio elementus, pradėdami nuo mažesnio elektrinio neigiamumo elemento. | LiO | AlO |
2. Nurodome, kiek elementų atomai gali prisijungti ar atiduoti elektronų. | Li+O2– (krūvio, kuris lygus 1, nerašome) | Al3+O2– |
3. Randame mažiausią bendrąjį kartotinį (MBK). | MBK (1; 2) = 2 | MBK (3; 2) = 6 |
4. Mažiausią bendrąjį kartotinį dalijame iš elementų atomų krūvio. Gautas rezultatas atitinkamo elemento indeksas. | 2 : 1 = 2 (ličio indeksas) | 6 : 3 = 2 (aliuminio indeksas) |
5. Užrašome cheminio junginio formulę. | Li₂O (deguonies indeksas lygus 1, jo nerašome) | Al₂O₃ |
Klausimai ir užduotys
- Paaiškinkite, kaip sudaromos joninių junginių cheminės formulės. Kodėl elementų atomai siekia užpildyto išorinio elektronų sluoksnio?
- Kas bendra tarp natrio jono, neono atomo ir jono, gauto iš fluoro atomo?
- Vienodas elektronų skaičius
- Vienodas protonų skaičius branduolyje
- Vienodas neutronų skaičius
- Vienodas elektronų skaičius išoriniame elektronų sluoksnyje
- Remdamiesi 3.5.7 paveikslo pavyzdžiu, pavaizduokite magnio ir chloro junginio susidarymą. Užrašykite šio junginio formulę.
- Sudarykite natrio ir azoto junginio cheminę formulę.
- Sudarykite aliuminio junginių su chloru ir deguonimi chemines formules.
Ko išmokome?
- Junginių cheminėmis formulėmis rodoma, iš kokių elementų yra sudaryti junginiai ir koks yra tų elementų santykis.
- Cheminė formulė – tai elemento ar junginio sandaros išraiška, vaizduojama simboliais ir indeksais.
- Susijungus metalui su nemetalu, susidaro joninis junginys.
- Joninių junginių formulės yra empirinės – jomis rodoma, kokiu santykiu junginio elementai jungiasi vieni su kitais.
- Atiduotų ir prijungtų elektronų skaičius junginyje turi sutapti.

