Oksidacijos-redukcijos reakcijos
Jau žinote, kad, elementams reaguojant su deguonimi, susidaro elementų oksidai.
Panagrinėkime oksidų susidarymo reakcijas smulkiau. Kaip pavyzdį paimkime metalą litį ir deguonį:
4Li(k) + | O2(d) → | 2Li2O(k). |
Litis | Deguonis | Ličio oksidas |
(4.3.1)
Jau žinome, kad jungiantis šiems elementams litis atiduoda savo elektroną deguonies atomui. Deguonies atomui trūksta dviejų elektronų, kad susidarytų užpildytas elektronų sluoksnis (4.3.1 pav.).
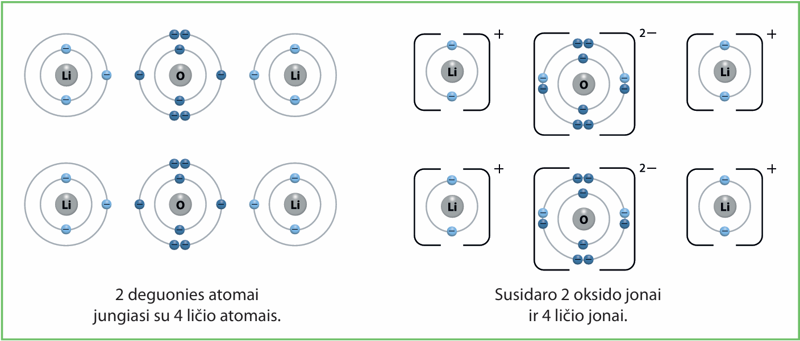
Kaip matome iš šio paveikslėlio, tam, kad iš vieno deguonies atomo susidarytų oksido jonas, reikia dviejų ličio atomų. Oksido jonas pritraukia 2 ličio elektronus, todėl jo krūvis yra 2–. Kiekvieno iš gautų ličio jonų krūvis lygus 1+ (vieneto nerašome, tik pliuso ženklą).
Kadangi deguonies molekulė yra dviatomė, susidaro du oksido jonai, kurie prisijungia keturis elektronus. Vienas ličio atomas atiduoda vieną elektroną, todėl reikia keturių ličio atomų.
Aptartoje reakcijoje ličio atomai atidavė savo elektronus, o deguonies atomai juos prisijungė.
Reakcijos, kurioms vykstant vieni elementai atiduoda elektronus, o kiti juos prisijungia, vadinamos oksidacijos-redukcijos reakcijomis. Oksidacija (elektronų atidavimas) ir redukcija (elektronų prijungimas) visada vyksta kartu.
Mūsų nagrinėjamame ličio oksido junginyje Li2O ličio jonas yra reduktorius, o deguonies jonas – oksidatorius.
Atomai arba jonai, kurie vykstant reakcijai prisijungia elektronus, vadinami oksidãtoriais. Vyksta redukcija, taigi jie yra redukuojami.
Atomai arba jonai, kurie vykstant reakcijai praranda elektronus, vadinami redùktoriais. Vyksta oksidacija, šie atomai ar jonai yra oksiduojami.
Tai įdomu!
Žodis OPERA padės prisiminti, kas yra oksidatorius, o kas – reduktorius:
oksidatoriai prisijungia elektronus, reduktoriai atiduoda.
Ličio oksido reakciją galima užrašyti šiomis lygtimis, kurios vadinamos dalinėmis lygtimis:
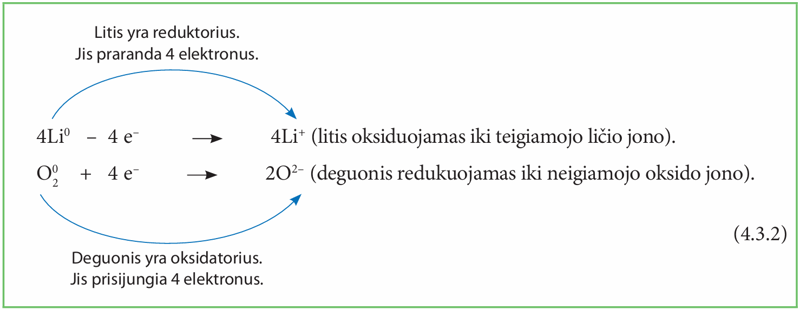
Gauname tokią oksidacijos-redukcijos lygtį:

Elektronų balanso metodas
Vykstant oksidacijos-redukcijos reakcijoms atiduodamų ir prijungiamų elektronų skaičius turi sutapti, kitaip tariant, turi būti atiduodamų ir prijungiamų elektrònų balánsas.
Taikydami elektronų balanso metodą, galime nesunkiai išlyginti reakcijų lygtis.
Uždavinys
Išlyginkime aliuminio degimo deguonyje reakcijos lygtį.
Sprendimas
Iš pradžių parašykime bendrąją reakcijos lygtį, atspindinčią aliuminio oksido susidarymą iš aliuminio. Aliuminio jono krūvis lygus 3+, o oksido 2–. Aliuminio oksido formulė yra Al2O3. Neišlyginta reakcijos lygtis atrodo taip:
Al + O2 → Al2O3.
(4.3.4)
Dabar parašykime šios reakcijos dalines lygtis:
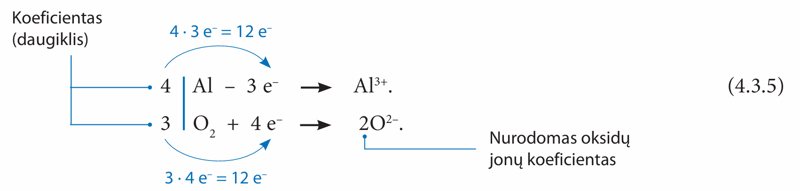
Tam, kad atiduodamų ir prijungiamų elektronų skaičius sutaptų, reikia parinkti daugiklius – koeficientus. Aliuminio atiduodamus elektronus reikia padauginti iš koeficiento 4, o deguonies pritraukiamus elektronus – iš koeficiento 3. Tada bendras perėjusių elektronų skaičius bus lygus – po 12. Tokius pačius koeficientus reikia parašyti ir bendrojoje reakcijos lygtyje. Kadangi aliuminio oksido formulėje Al2O3 yra du aliuminio jonai (indeksas lygus 2), prieš aliuminio oksido molekulę rašomas koeficientas 2, o ne 4:

Naudojantis elektronų balanso lygtimis galima išlyginti ne tik tas oksidacijos-redukcijos lygtis, kai susidaro jonai, bet ir tokias, kai jonai nesusidaro. Kaip žinome, kai elementų elektrinio neigiamumo skirtumas yra mažesnis nei 1,8, susidaro kovalentinis polinis ryšys. Šiuo atveju galima apskaičiuoti elementų oksidacijos laipsnį.
Oksidacijos laipsnis
Elemeñto oksidãcijos láipsnis yra dydis, kuris rodo, kiek elektronų galėtų prijungti ar atiduoti elementas, jei susidarytų joninis ryšys.
Teigiamąjį oksidacijos laipsnį įgyja elementai, kurių atomai galėtų atiduoti elektronus.
Neigiamąjį oksidacijos laipsnį įgyja elementai, kurių atomai galėtų prijungti elektronus, tai yra tokie, kurių elektrinis neigiamumas didesnis.
Pavyzdžiui, sieros dioksidas yra molekulė, kurioje tarp sieros ir deguonies yra kovalentinis polinis ryšys (šių elementų elektrinio neigiamumo skirtumas 0,86). Parašykime sieros dioksido molekulės formulę, nurodydami elementų oksidacijos laipsnį. Sieros oksidacijos laipsnis bus teigiamasis, o deguonies – neigiamasis (deguonies elektrinis neigiamumas yra didesnis už sieros).
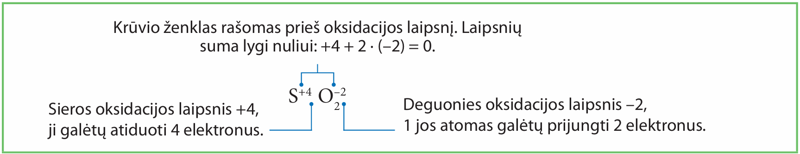
Molekulė neturi krūvio, todėl teigiamųjų ir neigiamųjų laipsnių suma turi būti lygi nuliui. Atkreipkime dėmesį – nurodant oksidacijos laipsnį krūvio ženklas rašomas prieš laipsnio skaitmenį, kitaip negu nurodant jono krūvį. Lygindami oksidacijos-redukcijos reakcijų lygtis galime laikytis tų pačių principų: skaičiuoti perėjusius elektronus, nors žinome, kad elektronai visiškai nepereina, o tik pasislenka didesnį elektrinį neigiamumą turinčio elemento link.
Uždavinys
Išlyginkime fosforo degimo reakcijos lygtį, žinodami, kad susidaro fosforo(V) oksidas, kurio formulė P2O5. Kadangi deguonies oksidacijos laipsnis –2, 5 deguonies atomai sudarytų krūvį, lygų –10. Tada fosforo oksidacijos laipsnis šiame junginyje apskaičiuojamas taip: 10 : 2 = +5. Šios reakcijos lygtis:
.
(4.3.7)
Parašykime šios reakcijos dalines lygtis:
(4.3.8)
Matome, kad elektronų balansas bus pasiektas, kai bus prijungta ir perduota po 20 elektronų. Tada išlyginta reakcijos lygtis bus tokia:
(4.3.9)
Klausimai ir užduotys
- Ką vadiname oksidacija ir redukcija?
- Kuris šių elementų yra geriausias oksidatorius?
- Litis
- Aliuminis
- Deguonis
- Siera
- Nustatykite chloro oksidacijos laipsnį šiuose junginiuose:
- KCl;
- Cl2;
- Cl2O;
- Cl2O7.
- Elektronų balanso metodu išlyginkite kalcio reakcijos su deguonimi lygtį. Nurodykite oksidatorių ir reduktorių.
- Fosforas jungiasi su chloru pagal šią lygtį: P(k) + Cl2(d) → PCl5(k). Elektronų balanso metodu išlyginkite šią lygtį. Nurodykite oksidatorių ir reduktorių.
Ko išmokome?
- Oksidacija vadinamas elektronų atidavimas.
- Redukcija yra elektronų prijungimas.
- Vykstant oksidacijos-redukcijos reakcijoms atiduodamų ir prijungiamų elektronų skaičius turi sutapti.
- Elemento oksidacijos laipsnis yra dydis, kuris rodo, kiek elektronų galėtų prijungti ar atiduoti elementas, jei susidarytų joninis ryšys.
- Molekulės teigiamųjų ir neigiamųjų oksidacijos laipsnių suma turi būti lygi nuliui.
- Nurodant oksidacijos laipsnį krūvio ženklas rašomas prieš laipsnio skaitmenį.
