Skaičiavimai remiantis cheminių reakcijų lygtimis
Kaip įsitikinome, cheminėje reakcijoje dalyvaujančių elemento dalelių (atomų arba iš jų susidariusių jonų) skaičius prieš reakciją ir po jos nepakinta. Vadinasi, medžiagų masė prieš reakciją lygi medžiagų masei po reakcijos. Tai įvardijome kaip masės tvermės dėsnį. Tačiau žinome, kad atomai ir molekulės yra labai mažos, lengvos dalelės, todėl naudojame santykinę atominę ir santykinę molekulinę masę (žr. 3.9 temą). Žinodami, kad cheminės medžiagos reaguoja tam tikromis proporcijomis, galime panaudoti santykinės molekulinės masės skaitines reikšmes. Skaičiuojant labai patogu šias reikšmes paversti gramais.
Pavyzdžiui, vandens santykinė molekulinė masė yra 18. Ji gaunama sudėjus dviejų vandenilio atomų ir vieno deguonies atomo santykinę atominę masę (1 + 1 + 16). Akivaizdu, kad 18 g vandens būtų ta proporcija, kuri atitinka vandens santykinę molekulinę masę. Lygiai taip pat anglies santykinė atominė masė lygi 12, o jos skaitinė reikšmė, paversta gramais, lygi 12 g. Anglies dioksido, kurio formulė CO2, santykinė molekulinė masė gaunama sudėjus anglies santykinę atominę masę ir dviejų deguonies atomų santykinę atominę masę. Tada anglies dioksido santykinė molekulinė masė yra:
12 + 2 · 16 = 44.
Vadinasi, skaičiavimams galime naudoti proporciją 44 g.
Išspręskime keturis skirtingų junginių uždavinius. Juose panaudokime santykinės atominės arba molekulinės masės reikšmes, paversdami jas gramais.
1 uždavinys
Paimkime anglies dioksidą CO2. Nesunku suskaičiuoti, kad iš 12 g anglies gausime 44 g anglies dioksido. Kaip gavome šį dydį?
Sprendimas
Parašykime reakcijos lygtį:
C(k) + | O2(d) → | CO2(d). |
Anglis | Deguonis | Anglies dioksidas |
(4.4.1)
Anglies santykinė atominė masė yra 12, vieno deguonies atomo – 16. Anglies dioksido santykinė molekulinė masė gaunama sudėjus visų elementų santykinę atominę masę. Ji lygi 44, taigi iš 12 g anglies gausime 44 g anglies dioksido.
Ši proporcija bus išlaikoma ir tuo atveju, jei bus paimta mažesnė arba didesnė už 12 g anglies masė. Pavyzdžiui, iš 6 g anglies gautume 22 g anglies dioksido (du kartus mažiau), o iš 24 g anglies gautume 88 g anglies dioksido (du kartus daugiau).
Medžiagos reaguoja tomis pačiomis proporcijomis, kokios yra tarp medžiagų dalelių.
Tuo galima pasinaudoti norint apskaičiuoti, kiek pradinių medžiagų reikia reakcijoms sukelti, kiek reakcijos produktų susidarys.
2 uždavinys
Panagrinėkime magnio oksido junginį 2MgO. Galima suskaičiuoti, kiek magnio degimo produkto – magnio oksido susidarys iš 6 g magnio. Veiksmus pažymėkime reakcijos lygtyje.
Sprendimas
Parašykime reakcijos lygtį ir žinomus duomenis.
Turimą pradinės medžiagos masę gramais pažymėkime virš medžiagos simbolio. | Ieškomos medžiagos masę pažymėkime kintamuoju x; šį kintamąjį pažymėkime virš magnio oksido simbolio. |
6 g | x g |
2Mg(k) + O2(d) → | 2MgO(k). |
2 · 24 = 48 g | 2 · (24 + 16) = 80 g |
| (4.4.2) |
Po magnio simboliu pažymėkime magnio santykinę atominę masę gramais, padaugintą iš dviejų, nes reikalingi du atomai. | Po magnio oksidu įrašome magnio ir deguonies santykinę molekulinę masę gramais, padaugintą iš dviejų, nes gaunamos dvi dalelės. |
Sudarome tokią proporciją:
Atsakymas: gausime 10 g magnio oksido.
Tai įdomu!
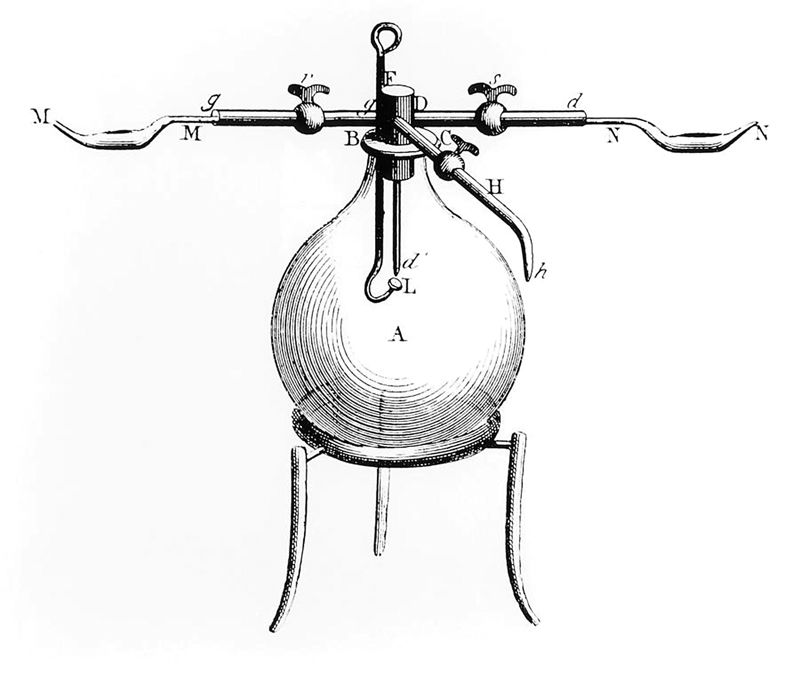
A. Lavuazjė atrado masės tvermės dėsnį, tyrinėdamas gyvsidabrio reakciją su deguonimi specialiame prietaise (4.4.1 pav.). Jis apskaičiavo, kiek gyvsidabrio oksido susidarė iš pasverto gyvsidabrio ir kiek deguonies buvo sunaudota. Kaitindamas gyvsidabrio oksidą jis vėl gavo deguonį ir gyvsidabrį, tada nustatė jų masę. Taip buvo įrodyta, jog elementai reaguoja tam tikromis proporcijomis ir kad pradinių medžiagų ir jų produktų masė sutampa. Šie tyrinėjimai 1789 m. sukėlė tikrą chemijos revoliuciją ir padėjo šiuolaikinės chemijos pagrindus.
3 uždavinys
Paimkime trečiąjį pavyzdį – aliuminio chloridą (AlCl3). Apskaičiuokime, kiek gramų chloro reikia, kad jame sudegtų 5,4 g aliuminio. Chlorui būdingas ypač didelis elektrinis neigiamumas, todėl jis prisijungia elektronus. Vienam chloro atomui reikia vieno elektrono iki visiško išorinio elektronų sluoksnio užpildymo. Vadinasi, dviatomei chloro molekulei reikės 2 elektronų. Aliuminis, veikiamas chloro, atiduoda 3 elektronus. Taigi aliuminio chlorido formulė yra AlCl3.
Sprendimas
Parašykime reakcijos lygtį:
Al(k) + Cl2(d) → AlCl3(k).
(4.4.3)
Išlyginkime šią lygtį, kaip parodyta 4.3 temoje:
5,4 g | x g | |
2Al(k) + | 3Cl2(d) → | 2AlCl3(k). |
2 · 27 = 54 g | 3 · 2 · 35,5 = 213 g | (4.4.4) |
Dabar pagal išlygintą lygtį apskaičiuokime, kiek gramų chloro reikės 5,4 g aliuminio. Šį dydį ir ieškomą chloro masę, kurią pažymime nežinomuoju x, rašome virš lygties. Žinodami, kad elementai reaguoja proporcingai, lygties apačioje parašykime skaitines santykinės molekulinės masės reikšmes, įvertindami lygties koeficientus ir paversdami šias skaitines reikšmes gramais.
Gausime tokią proporciją:
Atsakymas: reikės 21,3 g chloro.
4 uždavinys
Panagrinėkime paskutinį, geležies sulfido (FeS), pavyzdį. Žinome, kad medžiagos jungiasi tam tikromis proporcijomis. O kas nutiktų, jei kurios nors medžiagos būtų paimta daugiau, negu reikia? Ta dalis medžiagos, kurios nereikia, liktų nesureagavusi. Apskaičiuokime, kas atsitiktų, jei sumaišytume 5,6 g geležies su tiek pat sieros. Kiek šių elementų junginio – geležies sulfido – gautume?
Sprendimas
Pažymėkime ieškomą geležies sulfido masę simboliu x. Kaip ir ankstesniais atvejais, parašykime reakcijos lygtį. Virš jos nurodykime turimų medžiagų masę. Apačioje parašykime šių medžiagų santykinės atominės ir molekulinės masės skaitines reikšmes gramais.
5,6 g | 5,6 g | x g |
Fe(k) + | S(k) → | FeS(k). |
56 g | 32 g | 88 g |
(4.4.5)
Pirmiausia išsiaiškinkime, kurios medžiagos yra per daug. Pavyzdžiui, suskaičiuokime, kiek gramų sieros reikės 5,6 g geležies. Pažymėkime ieškomą sieros masę kintamuoju y. Galime sudaryti tokią proporciją:
Kaip matome iš šių skaičiavimų, 5,6 g geležies reikia tik 3,2 g sieros. Vadinasi, paimtas sieros kiekis (5,6 g) yra per didelis. Tai vadinama sieros pertekliumi. Norint apskaičiuoti susidariusio geležies sulfido masę, skaičiavimams galima naudoti arba 5,6 g geležies masę, arba reikiamą 3,2 g sieros masę. Kita sieros dalis, kurios masė lygi 5,6 g – 3,2 g = 2,4 g, liks nesureagavusi. Sieros perteklius sudaro 2,4 g.
Dabar apskaičiuokime, kiek gramų geležies sulfido galima gauti iš 5,6 g geležies. Sudarykime naują proprociją, išreikšdami ieškomą geležies sulfido masę kintamuoju x:
Atsakymas: 8,8 g geležies sulfido. Tokį pat rezultatą gautume, jei skaičiavimams pasirinktume 3,2 g sieros masę, nes tik tiek sieros reikia.
Klausimai ir užduotys
- Apskaičiuokite, kiek gramų sieros dioksido galima gauti sudeginus ore 16 g sieros.
- Apskaičiuokite, kiek anglies reikia sudeginti esant deguonies pertekliui, norint gauti 22 g anglies dioksido.
- Virš 1,4 g įkaitinto ličio chloro srovė buvo leidžiama tol, kol visas litis virto ličio chloridu. Parašykite reakcijos lygtį ir apskaičiuokite, kiek gramų ličio chlorido susidarė.
- Nurodykite, kiek deguonies reikės, kad visiškai sudegtų 12 g magnio. Parašykite sprendimą.
- 8 g
- 16 g
- 24 g
- 32 g
- Uždarame inde, kuriame buvo 0,4 g deguonies, sudeginta 0,27 g aliuminio. Apskaičiuokite, ar visas aliuminis sudegė. Kurios medžiagos liko? Kokia susidariusio degimo produkto masė?
Ko išmokome?
- Cheminės medžiagos reaguoja tam tikromis proporcijomis.
- Medžiagos reaguoja tomis pačiomis proporcijomis, kokios yra tarp medžiagų dalelių.
- Skaičiuojant reakcijos medžiagų masę galima naudotis santykinės molekulinės masės skaitine reikšme, išreikšta gramais.
- Cheminėje reakcijoje dalyvaujančių elemento dalelių (atomų arba iš jų susidariusių jonų) skaičius prieš reakciją ir po jos nepakinta.
- Medžiagų masė prieš reakciją lygi medžiagų masei po reakcijos.
- Jei kurios nors pradinės medžiagos paimama per daug (perteklius), ji nesureaguoja ir nedalyvauja reakcijoje.
